KARDIOMIOPATI DIABETIK
Oleh : Alwi Shahab
- Pendahuluan
Hubungan antara payah jantung dan diabetes melitus telah lama diketahui orang, namun adanya kardiomiopati diabetik sebagai suatu kelainan klinis tersendiri masih terus diperdebatkan. Pada tahun 1881, Leyden mengemukakan bahwa payah jantung merupakan penyulit DM yang sering ditemukan. Mayer menyatakan bahwa penyakit jantung pada diabetes melitus dapat terjadi akibat gangguan metabolisme. Pada tahun 1972, Rubler dan kawan kawan mengemukakan istilah kardiomiopati diabetik, setelah melakukan studi post mortem terhadap 4 orang pasien diabetes melitus yang meninggal akibat payah jantung tanpa adanya riwayat alkoholisme, hipertensi, penyakit jantung koroner atau penyakit jantung katup. Diseksi anatomik dari jantung pasien-pasien tersebut menunjukkan adanya hipertrofi ventrikel kiri dan fibrosis tanpa atheroma arteri koroner. Kelainan ini kemudian dikenal dengan kardiomiopati diabetik. Kardiomiopati diabetik merupakan entitas klinis yang masih membingungkan, walaupun penelitian klinis dan biomolekular telah dilakukan lebih dari 3 dekade. Hal ini antara lain dikarenakan belum ada kesepakatan dalam mendefinisikan kardiomiopati diabetik.
II. Definisi
Kardiomiopati diabetik adalah kelainan kardiovaskular yang terjadi pada pasien Diabetes Melitus, ditandai dengan dilatasi dan hipertrofi miokardium, penurunan fungsi sistolik dan diastolik dari ventrikel kiri serta proses terjadinya tidak berhubungan dengan penyebab-penyebab umum dari penyakit jantung seperti penyakit jantung koroner, penyakit jantung katup dan penyakit jantung hipertensif.
Kardiomiopati diabetik dapat terjadi tanpa gejala selama beberapa tahun sebelum timbul gejala-gejala dan tanda-tanda klinis yang nyata. Stadium awal dari kardiomiopati diabetik ditandai dengan perubahan patologik didalam interstisium miokardium. Hiperglikemi kronik merupakan faktor penyebab utama terjadinya kardiomiopati diabetik, karena dapat menyebabkan kelainan ditingkat kardiomiosit yang pada akhirnya akan menimbulkan gangguan struktur dan fungsi jantung.
III. Epidemiologi
Bukti-bukti epidemiologi dari seluruh dunia menunjukkan bahwa komplikasi makrovaskular (Penyakit arteri koroner, Penyakit vaskuler perifer dan stroke) lebih sering ditemukan diantara pasien diabetes melitus dibandingkan populasi non diabetes. Angka kematian akibat penyakit arteri koroner 3 kali lebih sering terjadi pada pasien DM dibandingkan populasi non DM pada umur dan jenis kelamin yang sama. Prevalensi payah jantung pada populasi umum berkisar antara 1 sampai 4%, namun pada pasien DM sebesar 12%. Prevalensi meningkat sebesar 22% pada pasien diatas usia 64 tahun. Lebih sepertiga dari semua pasien yang masuk rumah sakit dengan payah jantung adalah pengidap Diabetes Melitus. Diabetes Melitus juga merupakan prediktor kuat terhadap morbiditas dan mortalitas kardiovaskular serta merupakan faktor risiko independen terhadap kematian pada pasien dengan payah jantung. The Framingham Heart Study melaporkan sebesar 2,4 kali peningkatan angka kejadian payah jantung pada laki-laki DM dan sebesar 5,1 kali pada wanita DM, dibandingkan populasi non DM. Studi lain dengan populasi yang lebih besar juga menunjukkan hasil yang sama. The Cardiovascular Health Study (CHS) yang dilakukan pada pasien-pasien diatas umur 65 tahun menunjukkan bahwa DM disertai dengan peningkatan angka kejadian payah jantung. The Strong Heart Study (SHS) menunjukkan adanya hubungan yang kuat antara DM dan massa ventrikel kiri, penebalan dinding ventrikel, peningkatan kekakuan arteri dan disfungsi diastolik, dibandingkan dengan kelompok kontrol. Informasi terbaru dari studi MESA ( Multi-Ethnic Study of Atherosclerosis) melaporkan adanya perbedaan inter-rasial dari massa ventrikel kiri, volume ventrikel kiri dan fungsi ventrikel kiri diantara pasien DM. Studi cross sectional melaporkan tingginya prevalensi payah jantung pada populasi DM. Pada studi selama 43 bulan, angka kejadian payah jantung lebih tinggi pada pasien DM (39%) dibandingkan dengan pasien non DM (23%) dengan risiko relatif 1,3 untuk menjadi payah jantung. Studi UKPDS (UK Prospective Diabetes Study) mendapatkan peningkatan prevalensi payah jantung pada pasien DM tipe 2, yang berkorelasi dengan tingginya kadar HbA1c. Setiap kenaikan 1% dari kadar HbA1c, risiko untuk mengalami payah jantung meningkat sebesar 8%.
IV. Patogenesis
Patogenesis kardiomiopati diabetik bersifat multifaktorial. Beberapa hipotesis telah dikemukakan, antara lain akibat disfungsi otonom, gangguan metabolisme, abnormalitas homeostasis ion, perubahan struktur protein dan fibrosis interstisium. Hiperglikemi yang berkepanjangan akan meningkatkan glikosilasi protein-protein interstisium seperti kolagen yang mengakibatkan kekakuan miokardium dan gangguan kontraksi miokardium. Mekanisme terjadinya gangguan kontraksi miokardium antara lain disebabkan karena beberapa keadaan, antara lain :
- Gangguan homeostasis kalsium
- Aktivasi sistem renin-angiotensin
- Peningkatan stres oksidatif
- Perubahan substrat metabolisme
- Disfungsi mitokondria
- Gangguan homeostasis kalsium
Kalsium intraseluler merupakan regulator utama kontraksi jantung. Didalam kardiomiosit, masuknya kalsium memicu aktivasi depolarisasi membran sel. Kalsium kemudian akan berdiffusi melalui ruang sitosol untuk mencapai protein kontraksi, berikatan dengan troponin C. Selanjutnya akan memicu terjadinya pergeseran filamen tipis dan tebal, yang menyebabkan kontraksi jantung pada fase sistolik. Kalsium kemudian kembali ke kadar diastolik melalui aktivasi Sarcoplasmic Reticulum Ca++2 pump (SERCA2a), sarcolemmal Na+-Ca+2 exchanger dan sarcolemmal Ca2+ ATPase.
Gangguan homeostasis kalsium yang merubah fungsi jantung pada DM terjadi akibat penurunan :
- – aktifitas enzim ATP ase
- – kemampuan ambilan kalsium oleh retikulum sarkoplasma
- – aktifitas sarcolemmal Na+-Ca+2 exchanger dan enzim sarcolemmal Ca2+ ATP ase.
- Aktivasi Sistem Renin Angiotensin
Peranan aktivasi sistem renin angiotensin dalam perkembangan kardiomiopati diabetik telah lama diketahui. Densitas reseptor Angiotensin II dan ekspresi mRNA mengalami peningkatan pada jantung pasien DM. Aktivasi sistem renin angiotensin pada DM disertai dengan peningkatan kerusakan oksidatif , apoptosis dan nekrosis kardiomiosit serta sel endotel. Hambatan terhadap sistem renin angiotensin dapat mengurangi produksi ROS (reactive oxygen species) pada hewan percobaan, dimana efeknya menyerupai efek terapi anti oksidan. Juga pada hewan percobaan menunjukkan bahwa terapi dengan ACE inhibitor kaptopril memberikan efek kardioprotektif.
- Peningkatan stres oksidatif
Peningkatan produksi ROS pada jantung pasien DM merupakan faktor pendukung terjadinya dan progresivitas kardiomiopati diabetik. Kerusakan dan disfungsi sel akibat pengaruh superoksida akan terjadi bila terjadi ketidakseimbangan antara pembentukan ROS dan kemampuan degradasi ROS. Meningkatnya pembentukan ROS dan menurunnya mekanisme pertahanan antioksidan akan meningkatkan stress oksidatif pada jantung pasien DM. Dalam kondisi fisiologis, sebagian besar ROS dihasilkan oleh mitokondria. Peningkatan produksi ROS didalam mitokondria dapat terjadi diberbagai jaringan seperti didalam sel endotel sebagai akibat pajanan yang lama dari hiperglikemi. Bukti-bukti dari beberapa penelitian menunjukkan adanya peningkatan produksi ROS dari sumber-sumber diluar mitokhondria seperti NADPH oxidase atau menurunnya aktifitas neuronal nitric oxide synthase (NOS 1) disertai dengan meningkatnya aktivasi xanthine oxidoreductase. Peningkatan produksi ROS disertai dengan peningkatan apoptosis, kerusakan DNA dan penurunan aktifitas jalur DNA repair. Disamping menimbulkan kerusakan ditingkat selular, peningkatan produksi ROS juga dapat menyebabkan gangguan fungsi jantung melalui mekanisme lain, seperti peningkatan aktivasi Protein Kinase C, Advanced Glycosylation End Products dan Jalur Aldose Reductase.
- Perubahan substrat metabolisme
Diabetes Melitus ditandai dengan penurunan metabolisme glukosa dan laktat serta peningkatan metabolisme asam lemak. Pada tikus percobaan diabetes, didapatkan peningkatan ambilan asam lemak yang melebihi kecepatan oksidasinya didalam jantung, sehingga menyebabkan akumulasi lemak didalam miokardium yang akan menimbulkan lipotoksisitas. Hasil-hasil sampingan metabolisme lemak seperti ceramide akan menyebabkan apoptosis kardiomiosit.
- Disfungsi mitokondria
Diabetes melitus menyebabkan perubahan fungsi dan struktur mitokondria. Gangguan fungsi mitokondria pada DM merupakan refleksi dari gangguan transkripsi gen yang terlibat dalam proses fosforilasi oksidatif , namun bukan gen yang terlibat dalam oksidasi asam lemak. Produksi hidrogen peroksida meningkat sedangkan kadar glutathione menurun pada jantung DM, hal ini menunjukkan terjadinya peningkatan produksi ROS yang berasal dari mitokondria.
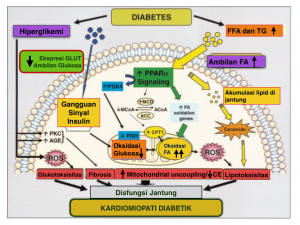
Gambar 1 . Kontributor utama yang berperan dalam patogenesis kardiomiopati diabetik. (Sumber : Circulation.2007;115:p.3216)
Keterangan gambar:
FFA = Free Fatty Acid PDK4 = Pyruvate dehydrogenase kinase 4
PPAR-a = Peroxisome Proliferator Activated Receptor-a MCD = Malonyl-coenzyme A decarboxylase
TG = Triglyceride MCoA= Malonyl-coenzyme A
GLUT = Glucose Transporter ACoA = Acetyl-coenzyme A
ACC = Acetyl coenzyme A carboxylase CPT1 = Carnitine-palmitoyl-transferase 1
PDH = Pyruvate dehydrogenase CE = Cardiac efficiency
PKC = Protein kinase C AGE = Advanced glycation end products
V. Gejala dan tanda
Gejala-gejala dan tanda-tanda klinis kardiomiopati diabetik dapat berupa perubahan struktur jantung yang berhubungan erat dengan perubahan fungsinya. Perubahan-perubahan tersebut antara lain :
- Hipertrofi Ventrikel Kiri (HVK)
Beberapa penelitian membuktikan adanya hubungan antara DM dan HVK. The Strong Heart Study (SHS) melaporkan terjadi peningkatan massa ventrikel kiri dan ketebalan dinding ventrikel kiri baik pada wanita maupun pria dengan DM. Temuan yang sama juga dilaporkan pada the Cardiovascular Health Study (CHS) dan the Multi-Ethnic Study of Atherosclerosis (MESA). Studi terbaru pada pasien DM tipe 2 di Jepang, melaporkan adanya hubungan antara resistensi insulin, kekakuan arteri dan indeks massa ventrikel kiri (menggunakan cardiac MRI).
Temuan ini juga didukung oleh penelitian dengan jumlah sampel yang lebih besar di Swedia yang menunjukkan adanya hubungan antara sindrom metabolik, resistensi insulin dan peningkatan massa dan ketebalan dinding ventrikel kiri.
- Disfungsi diastolik
Disfungsi diastolik ditandai dengan gangguan relaksasi dan pengisian pasif dari ventrikel kiri, sedangkan dikatakan payah jantung diastolik bila disfungsi diastolik disertai dengan peningkatan tekanan akhir diastolik ventrikel kiri, gambaran klinis payah jantung dengan fraksi ejeksi ventrikel kiri yang normal.
Disfungsi diastolik merupakan temuan umum baik pada orang normal maupun pada pasien-pasien kardiomiopati diabetik yang asimtomatik. Oleh karena itu, disfungsi diastolik merupakan pertanda gangguan fungsi dini pada kardiomiopati diabetik. Dalam suatu studi terhadap pasien DM tipe 2 dengan kendali glukosa darah yang baik, 47% ditemukan mengalami disfungsi diastolik.
- Disfungsi sistolik
Disfungsi sistolik adalah suatu keadaan dimana jantung tidak mampu memompa darah pada fase sistolik. Payah jantung sistolik adalah keadaan dimana terjadi tanda2 dan gejala2 payah jantung sebagai akibat dari disfungsi sistolik. Gambaran khas dari disfungsi sistolik adalah menurunnya fraksi ejeksi ventrikel kiri. Pada kardiomiopati diabetik, disfungsi sistolik terjadi belakangan, setelah sebelumnya pasien telah mengalami disfungsi diastolik yang berat. Jadi apabila telah ditemukan disfungsi sistolik pada pasien dengan kardiomiopati diabetik, menandakan prognosis yang buruk, dimana dalam suatu penelitian menunjukkan angka kematian sebesar 15-20% pertahun.
VI. Diagnosis
Walaupun tidak ada uji diagnostik khusus untuk menegakkan diagnosis kardiomiopati diabetik, namun dengan berbagai modalitas pencitraan yang berbeda diharapkan dapat mendeteksi gambaran kelainan jantung.
Saat ini pendekatan diagnostik yang umum digunakan dalam praktik klinis meliputi :
- Ekokardiografi
- Cardiac MRI
- Cardiac biomarker seperti NT-BNP [(N-Terminal pro-BNP (brain natriuretic peptide)]
- Ekokardiografi
Ekokardiografi merupakan pemeriksaan penunjang non invasif dan praktis dalam menentukan struktur dan fungsi jantung. Penilaian kuantitatif dan kualitatif jantung dapat dibuat melalui pemeriksaan geometri ventrikel kiri, wall motion, fungsi sistolik dan diastolik serta anatomi dan fungsi katup-katup jantung. Two dimensional echocardiography merupakan cara terpilih dalam mendeteksi dan menilai hipertrofi ventrikel kiri. Walaupun merupakan baku emas untuk menilai fungsi diastolik ventrikel kiri, namun kateterisasi jantung jarang digunakan untuk mendiagnosis disfungsi diastolik karena bersifat invasif. Pulse-wave Doppler echocardiography merupakan metoda yang paling praktis dan sering digunakan untuk menilai fungsi diastolik sedangkan Tissue Doppler Imaging (TDI) echocardiography merupakan metoda yang lebih sensitif dalam mendeteksi kelainan fungsi Ventrikel Kiri yang ringan.
- Cardiac Magnetic Resonance Imaging (MRI)
Cardiac MRI mempunyai akurasi yang lebih baik daripada ekokardiografi, dan merupakan baku emas dalam mengukur massa ventrikel kiri (left ventricular mass). Namun penggunaannya terbatas hanya untuk tujuan riset dikarenakan biayanya mahal, memakan waktu lama dan memerlukan keahlian khusus.
- Cardiac biomarkers
Brain Natriuretic Peptide (BNP) merupakan hormon jantung yang dihasilkan sebagai respons terhadap kelebihan tekanan dan volume ventrikel.
Walaupun BNP sensitif dan spesifik untuk payah jantung kongestif, namun tidak dapat membedakan antara payah jantung sistolik dan diastolik, sehingga membatasi kegunaannya dalam mendiagnosis kardiomiopati diabetik.
VII. Penatalaksanaan
- Kendali glikemik
Kendali glikemik yang buruk pada pasien DM, akan meningkatkan risiko kematian kardiovaskular, dimana setiap kenaikan 1% kadar HbA1c terjadi peningkatan kematian kardiovaskular sebesar 11%. Perbaikan kendali glikemik akan memberikan efek menguntungkan terhadap penurunan morbiditas dan mortalitas kardiovaskular.
Namun UKPDS (United Kingdom Prospective Diabetes Study) gagal membuktikan manfaat kendali glukosa darah intensif dalam menurunkan angka kejadian penyakit kardiovaskular pada pasien DM tipe 2 menggunakan sulfonilurea atau insulin. Sangat penting dicatat bahwa terdapat keterbatasan metodologi dalam penelitian UKPDS dalam hal interpretasi hasil penelitian. Pada penelitian DCCT (Diabetes Control and Complication Trial), sebanyak 1441 pasien DM tipe 1 secara acak diberikan terapi konvensional atau intensif selama rata-rata 6,5 tahun. Jumlah pasien yang mengalami komplikasi makrovaskular major sebanyak 40 orang pada kelompok yang mendapat terapi konvensional, sedangkan pada kelompok yang mendapat terapi intensif ditemukan sebanyak 23 orang. Secara statistik tidak bermakna, walaupun terjadi perbaikan profil lipid pada kelompok terapi intensif.
- Beta bloker
Stimulasi kronik dari sistem syaraf simfatis akan meningkatkan denyut jantung dan perubahan ekspresi gen yang akan menyebabkan remodelling jantung baik pada pasien dengan payah jantung maupun diabetes melitus. Secara tradisionil, terdapat keberatan penggunaan beta bloker pada pasien DM karena kekawatiran terhadap efek samping resistensi insulin dan meningkatkan risiko terjadinya hypoglycemia unawareness.
Namun dengan kemajuan pemahaman terhadap payah jantung dan kenyataan betapa pentingnya peranan sistem syaraf simfatis dalam pelepasan zat-zat vasoaktif, maka beta bloker menjadi penting peranannya dalam pengobatan payah jantung.
Jadi beta bloker berperan penting dalam mencegah bahkan memperbaiki remodelling jantung, sehingga dapat memperbaiki fungsi ventrikel kiri dan menurunkan mortalitas. Pada studi CIBIS II (Cardiac Insufficiency Bisoprolol Study II) dan MERIT-HF (Metoprolol Controlled-release Randomised Intervention Trial in Heart Failure) yang meneliti pasien-pasien dengan payah jantung ringan sampai sedang menunjukkan penurunan angka kematian 32 dan 34%. Carvedilol, suatu beta bloker generasi ketiga yang dapat menghambat reseptor alfa dan beta, bahkan menunjukkan efek yang sangat baik dalam menurunkan morbiditas dan mortalitas (penurunan sampai 67%). Pada studi yang lebih baru, the COVERNICUS (Carvedilol Prospective Randomized Cumulative Survival) study group menunjukkan penurunan mortalitas yang bermakna pada pasien-pasien dengan payah jantung yang diobati dengan carvedilol.
- ACE inhibitor
Studi multisenter terhadap kaptopril menunjukkan perbaikan yang bermakna dalam kemampuan latihan fisik dan gejala-gejala klinis payah jantung, tanpa pengaruh terhadap mortalitas. The CONSENSUS study group merupakan kelompok studi pertama yang menunjukkan penurunan mortalitas dengan enalapril pada pasien-pasien payah jantung berat. Peneliti-peneliti dari the SOLVD (Studies of Left Ventricular Dysfunction) memperkuat temuan ini dan juga mendapatkan bahwa enalapril dapat mencegah onset terjadinya payah jantung baru. Beberapa penelitian post infark miokard juga menunjukkan penurunan mortalitas dan morbiditas dengan ACE inhibitor dibanding plasebo. Manfaat yang jelas terhadap penurunan morbiditas dan mortalitas kardiovaskular ditemukan pada HOPE (Heart Outcomes Prevention Outcome) study yang menggunakan ramipril terhadap 9297 pasien dengan risiko tinggi, dimana manfaat hasil studi lebih jelas pada pasien-pasien DM. Selanjutnya dari HOPE study didapatkan penurunan sebanyak 33% dari timbulnya payah jantung baru dan penurunan sebanyak 44% dari risiko terjadinya DM tipe 2.
- Angiotensin II receptor antagonists
Angiotensin II merupakan pemain utama dalam terjadinya disfungsi jantung. The ELITE (Evaluation of Losartan in the Elderly) study yang membandingkan losartan dengan kaptopril pada pasien2 usia lanjut dengan payah jantung, mendapatkan bahwa losartan sama amannya dengan kaptopril dalam secondary end point nya.
- Ca++ channel antagonists
Studi pada hewan percobaan menunjukkan adanya perbaikan dari kardiomiopati diabetik dengan verapamil. Walaupun demikian studi2 dgn verapamil, diltiazem dan nifedipine menunjukkan efek merugikan terhadap payah jantung. Amlodipin dan felodipin yang diteliti dalam studi PRAISE (Prospective Randomized Amlodipine Survival Evaluation) dan Val-HeFT III (Valsartan Heart Failure Trial III), tidak menunjukkan manfaat lebih dibandingkan dengan pengobatan konvensional.
- Thiazolelidindione (TZD)
TZD bekerja meningkatkan sensitivitas insulin pada otot rangka dan jaringan lemak melalui ikatan dan aktivasi PPAR-gamma, suatu reseptor inti yang mempunyai peran regulasi proses differensiasi sel. Disamping itu TZD juga bekerja pada PPAR alfa dan meningkatkan kadar HDL cholesterol dan menurunkan kadar trigliserida. TZD juga meningkatkan ekspresi dan fungsi GLUT 4 didalam otot jantung, sehingga memperbaiki metabolisme glukosa dan menurunkan utilisasi NEFA oleh miokardium.
Oleh karena itu TZD dapat melindungi jantung dari jejas miokardium yang menyertai iskemi dan memperbaiki fungsi jantung setelah terjadi iskemi. Namun pemberian TZD harus hati2 pada pasien dengan payah jantung, karena sifatnya yang dapat menimbulkan retensi cairan.
- PARP inhibitors
PARP-1 (Poly Adenosine Diphosphate Ribose Polymerase-1) yang termasuk dalam golongan enzim PARP merupakan protein inti yang berfungsi sebagai suatu DNA-nick-sensor enzyme. Didalam sel endotel, dapat terjadi overproduksi superoksida akibat hiperglikemi, yang akan menyebabkan terbelahnya rantai DNA. Keadaan ini akan menyebabkan aktivasi PARP yang menghambat GAPDH (Glyceraldehyde-3-phosphate dehydrogenase). Akibatnya akan terjadi aktivasi sejumlah transduser utama dari kerusakan akibat hiperglikemi (polyol pathway, pembentukan AGEs dan aktivasi Protein Kinase C).
Selain memiliki efek langsung terhadap kerusakan DNA, PARP juga memodulasi proses inflamasi dan kerusakan sel sistem kardiovaskular melalui aktivasi terhadap NF-kB dan overekspresi endothelin-1 (ET-1) dan reseptor ET. Blokade aktifitas PARP dengan competitive PARP inhibitor, merupakan pendekatan rasional dalam mencegah kerusakan jaringan akibat aktivasi berbagai jalur yang disebabkan karena hiperglikemi kronik. Obat2 baru yang masih dalam penelitian, antara lain :
- AGEs inhibitor : aminoguanidine dan pyridoxamine
- AGEs cross-link breaker : alanine aminotransferase 711
- Modulator metabolisme asam lemak bebas : trimetazidine
- Copper chelator : trientine
Obat-obat antihiperglikemik yang baru seperti GLP-1 receptor agonists dan sodium-glucose cotransporter 2 inhibitor (SGLT2i) telah terbukti dapat menurunkan mortalitas kardiovaskular dan memperbaiki kendali glikemik. Namun, pengobatan pasien-pasien DM tipe 2 dengan payah jantung menggunakan GLP-1 receptor agonists, masih kontroversial. Beberapa studi pada pasien-pasien DM tipe 2 mendapatkan bahwa GLP-1 receptor agonists tidak berpengaruh terhadap MACE (major adverse cardiovascular events). Studi lain menunjukkan bahwa GLP-1 receptor agonists memberikan efek penurunan terhadap mortalitas kardiovaskular, angka kejadian infark miokard dan non fatal stroke, memperbaiki lipotoksisitas serta melindungi fungsi jantung pada pasien-pasien DM tipe 2.
Pada EMPA-REG Outcome trial, menunjukkan bahwa pasien-pasien DM tipe 2 yang mendapatkan empaglifozin, mengalami penurunan angka kematian kardiovaskular, hospitalisasi akibat payah jantung, serta kejadian non fatal infark miokard atau non fatal stroke. Pada CANVAS trial, Canaglifozin juga menunjukkan penurunan hospitalisasi akibat payah jantung pada pasien-pasien DM tipe 2.
Referensi :
- Almorós AL, Tuñón J, Orejas M, Cortés M, et.al. Diagnostic approaches for diabetic cardiomyopathy. Cardiovasc Diabetol 2017;16(28):1-14. DOI 10.1186/s12933‐017‐0506‐x
- Aneja A,Tang WHW,Bansilal S,Garcia MJ,Farkouh ME. Diabetic Cardiomyopathy. Insight into pathogenesis, diagnostic challenges and therapeutic options.Am J Med. 2008;121:748-757.
- Asghar O,Al-Sunni A,Khavandi K,et.al.Diabetic cardiomyopathy. Clinical Science 2009;116:741-760.
- Boudina S, Abel ED. Diabetic cardiomyopathy revisited. Circulation 2007 ;115:3213-3223.
- Boudina S. Clinical manifestations of diabetic cardiomyopathy. Heart Metab.2009;45:10-14.
- Fang Z.Y.,Prins J.B.,Marwick T.H. Diabetic Cardiomyopathy:Evidence,Mechanism, and Therapeutic Implications. Endocrine Reviews 2004;25:543-567.
- Farhangkhoee H, Khan ZA, Kaur H, et.al. Vascular endothelial dysfunction in diabetic cardiomyopathy: Pathogenesis and potential treatment targets. Pharmacology & Therapeutics 2006;111:384-399.
- Gunturiz AML, Chaparro P. Diabetic Cardiomyopathy: Cause or Consequence of Diabetes Mellitus? Cardiol Cardiovascmed 2017; 1 (4): 155-168.
- Gulsin GS, Athithan L, McCann GP. Diabetic cardiomyopathy : prevalence, determinants and potential treatments. Ther Adv Endocrinol Metab 2019;10:1-21..DOI: 10.1177/2042018819834869.
- Hayat S.A.,Patel B.,Khattar R.S.,Malik R.A. Diabetic cardiomyopathy: mechanisms, diagnosis and treatment.Clinical Science 2004;107:539-557.
- Jia G, Hill MA, Sowers JR. Diabetic Cardiomyopathy.An Update of Mechanisms Contributing to This Clinical Entity. Circ Res. 2018;122:624-638. DOI: 10.1161/CIRCRESAHA.117.311586.
- Jia G, Connell AW, Sowers JR. Diabetic cardiomyopathy: a hyperglycaemia- and insulin-resistance-induced heart disease. Diabetologia (2018) 61:21–28 DOI 10.1007/s00125-017-4390-4.
- Laksono S, Hosea GT, Nurusshofa Z. Diabetic Cardiomyopathy: Pathophysiology and Novel Therapies. Brown J Hosp Med 2022;1(3):1-4.
- Nakamura K, Niyoshi T, Yoshida M et.al. Pathophysiology and Treatment of Diabetic Cardiomyopathy and Heart Failure in Patients with Diabetes Mellitus. Int.J.Mol.Sci 2022;23(3587):1-14. https://doi.org/10.3390/ijms23073587
- Salvatore T, Pafundi PC,Galiero R et.al. The Diabetic Cardiomyopathy : The Contributing Pathophysiological Mechanisms. Frontiers in Medicine June 2021,Vol.8,Article 695792.pp.1-23. doi: 10.3389/fmed.2021.695792
- Voulgari C, Papadogiannis D, Tentolouris N. Diabetic cardiomyopathy: from the pathophysiology of the cardiac myocyte to current diagnosis and management strategies. Vascular Health and Risk Management 2010;6:883-903.
PENYAKIT JANTUNG KORONER PADA DIABETES MELITUS
Oleh : Alwi Shahab
Pendahuluan :
Penyebab kematian dan kesakitan utama pada penderita DM (baik DM tipe 1 maupun DM tipe 2) adalah Penyakit Jantung Koroner, yang merupakan salah satu penyulit makrovaskular pada diabetes melitus. Penyulit makrovaskular ini bermanifestasi sebagai aterosklerosis dini yang dapat mengenai organ-organ vital (jantung dan otak). Penyebab aterosklerosis pada penderita DM tipe 2 bersifat multifaktorial, melibatkan interaksi kompleks dari berbagai keadaan seperti hiperglikemi, hiperlipidemi, stres oksidatif, penuaan dini, hiperinsulinemi dan/atau hiperproinsulinemi serta perubahan-perubahan dalam proses koagulasi dan fibrinolisis. Pada penderita DM, risiko payah jantung kongestif meningkat 4 sampai 8 kali. Peningkatan risiko ini tidak hanya disebabkan karena penyakit jantung iskemik. Dalam beberapa tahun terakhir ini diketahui bahwa DM dapat pula mempengaruhi otot jantung secara independen. Selain melalui keterlibatan aterosklerosis dini arteri koroner yang menyebabkan penyakit jantung iskemik juga dapat terjadi perubahan-perubahan berupa fibrosis interstisial, pembentukan kolagen dan hipertrofi sel-sel otot jantung. Pada tingkat seluler terjadi gangguan pengeluaran kalsium dari sitoplasma, perubahan struktur troponin T dan peningkatan aktifitas Pyruvate Kinase. Perubahan2 ini akan menyebabkan gangguan kontraksi dan relaksasi otot jantung dan peningkatan tekanan end-diastolic sehingga dapat menimbulkan kardiomiopati restriktif. Dalam suatu tinjauan sistematik baru-baru ini terhadap 4.549.481 individu dengan DM tipe 2, ditemukan prevalensi keseluruhan dari komplikasi makrovaskular sebesar 32,2%, dimana penyakit jantung koroner merupakan bentuk penyakit kardiovaskular yang paling sering dilaporkan yaitu sebesar 21,2%. Setelah kematian jantung mendadak, yang merupakan subkategori terbesar kematian kardiovaskular pada individu dengan DM tipe 2, penyakit kardiovaskular aterosklerotik, infark miokard akut, dan stroke, merupakan komplikasi paling mematikan kedua. Pada individu dengan diabetes, penyakit jantung koroner sering terdeteksi pada tahap yang lebih lanjut dibandingkan dengan populasi non DM, karena mengalami silent myocardial ischemia, akibat adanya neuropati otonom. Beberapa penelitian menunjukkan bahwa diantara individu dengan diabetes tanpa penyakit jantung koroner yang ditetapkan secara klinis, hampir 75% sudah mengalami aterosklerosis koroner tingkat tinggi.Hal ini membuktikan bahwa pada individu dengan diabetes, proses arteriosklerotik berkembang lebih cepat, lebih awal, dan penyebarannya lebih luas.
Patofisiologi :
Dasar terjadinya peningkatan risiko Penyakit Jantung Koroner pada penderita DM belum diketahui secara pasti. Dari hasil penelitian didapatkan kenyataan bahwa :
- Angka kejadian aterosklerosis lebih tinggi pada penderita DM dibanding populasi non DM.
- Penderita DM mempunyai risiko tinggi untuk mengalami trombosis, penurunan fibrinolisis dan peningkatan respons inflamasi.
- Pada penderita DM terjadi glikosilasi protein yang akan mempengaruhi integritas dinding pembuluh darah.
Haffner dan kawan-kawan, membuktikan bahwa aterosklerosis pada penderita DM mulai terjadi sebelum timbul onset klinis DM. Studi epidemiologik juga menunjukkan terjadinya peningkatan risiko payah jantung pada penderita DM dibandingkan populasi non DM, yang ternyata disebabkan karena kontrol gula darah yang buruk dalam waktu yang lama. Disamping itu berbagai faktor turut pula memperberat risiko terjadinya payah jantung dan stroke pada penderita DM, antara lain hipertensi, resistensi insulin, hiperinsulinemi, hiperamilinemi, dislipidemi, dan gangguan sistem koagulasi serta hiperhomosisteinemi.
Semua faktor risiko ini kadang-kadang dapat terjadi pada satu individu dan merupakan suatu kumpulan gejala yang dikenal dengan istilah sindrom resistensi insulin atau sindrom metabolik.
Lesi aterosklerosis pada penderita DM dapat terjadi akibat :
- Hiperglikemi
Hiperglikemi kronik menyebabkan disfungsi endotel melalui berbagai mekanisme antara lain :
– Hiperglikemi kronik menyebabkan glikosilasi non enzimatik dari protein dan makromolekul seperti DNA, yang akan mengakibatkan perubahan sifat antigenik dari protein dan DNA. Keadaan ini akan menyebabkan perubahan tekanan intravaskular akibat gangguan keseimbangan Nitrat Oksida (NO) dan prostaglandin.
– Hiperglikemi meningkatkan aktivasi PKC intraseluler sehingga akan menyebabkan gangguan NADPH pool yang akan menghambat produksi NO.
– Overekspresi growth factors meningkatkan proliferasi sel endotel dan otot polos pembuluh darah sehingga akan terjadi neovaskularisasi.
– Hiperglikemi akan meningkatkan sintesis diacylglyerol (DAG) melalui jalur glikolitik. Peningkatan kadar DAG akan meningkatkan aktifitas PKC. Baik DAG maupun PKC berperan dalam memodulasi terjadinya vasokonstriksi.
– Sel endotel sangat peka terhadap pengaruh stres oksidatif. Keadaan hiperglikemi akan meningkatkan tendensi untuk terjadinya stres oksidatif dan peningkatan oxidized lipoprotein, terutama small dense LDL-cholesterol (oxidized LDL) yang lebih bersifat aterogenik. Disamping itu peningkatan kadar asam lemak bebas dan keadaan hiperglikemi dapat meningkatkan oksidasi fosfolipid dan protein.
- Hiperglikemi akan disertai dengan tendensi protrombotik dan aggregasi platelet. Keadaan ini berhubungan dengan beberapa faktor antara lain penurunan produksi NO dan penurunan aktifitas fibrinolitik akibat peningkatan kadar PAI-1. Disamping itu pada DM tipe 2 terjadi peningkatan aktifitas koagulasi akibat pengaruh berbagai faktor seperti pembentukan advanced glycosylation end products (AGEs) dan penurunan sintesis heparan sulfat.
- Walaupun tidak ada hubungan langsung antara aktivasi koagulasi dengan disfungsi endotel, namun aktivasi koagulasi yang berulang dapat menyebabkan overstimulasi dari sel-sel endotel sehingga akan terjadi disfungsi endotel.
- Resistensi insulin dan hiperinsulinemi
Jialal dan kawan-kawan menemukan adanya reseptor terhadap insulin yaitu IGF-I dan IGF-II pada sel-sel dari pembuluh darah besar dan kecil dengan karakteristik ikatan yang sama dengan yang ada pada sel-sel lain. Peneliti ini menyatakan bahwa reseptor IGF-I dan IGF-II pada sel endotel terbukti berperan secara fisiologik dalam proses terjadinya komplikasi vaskular pada penderita DM. Defisiensi insulin dan hiperglikemi kronik dapat meningkatkan kadar total protein kinase C (PKC) dan diacylglycerol (DAG). Insulin juga mempunyai efek langsung terhadap jaringan pembuluh darah. Pada penelitian terhadap jaringan pembuluh darah dari obese Zucker rat didapatkan adanya resistensi terhadap sinyal PI3-kinase. Temuan ini membuktikan bahwa resistensi insulin akan menimbulkan gangguan langsung pada fungsi pembuluh darah. King dan kawan-kawan dalam penelitiannya menggunakan kadar insulin fisiologis mendapatkan bahwa hormon ini dapat meningkatkan kadar dan aktifitas mRNA dari eNOS sebesar 2 kali lipat setelah 2-8 jam inkubasi sel endotel. Peneliti ini menyimpulkan bahwa insulin tidak hanya memiliki efek vasodilatasi akut melainkan juga memodulasi tonus pembuluh darah. Toksisitas insulin (hiperinsulinemi / hiperproinsulinemi) dapat menyertai keadaan resistensi insulin/ sindrom metabolik dan stadium awal dari DM tipe 2. Insulin meningkatkan jumlah reseptor AT-1 dan mengaktifkan Renin Angiotensin Aldosterone System (RAAS). Akhir-akhir ini telah dapat diidentifikasi adanya reseptor AT-1 didalam sel-sel beta pankreas dan didalam sel-sel endotel kapiler pulau2 Langerhans pankreas. Jadi, hiperinsulinemi mempunyai hubungan dengan Ang-II dengan akibat akan terjadi peningkatan stres oksidatif didalam pulau2 Langerhans pankreas akibat peningkatan kadar insulin, proinsulin dan amilin.
- Hiperamilinemi
Amilin atau disebut juga Islet Amyloid Polypeptide (IAPP) merupakan polipeptida yang mempunyai 37 gugus asam amino, disintesis dan disekresi oleh sel-sel beta pankreas bersama-sama dengan insulin. Jadi keadaan hiperinsulinemi akan disertai dengan hiperamilinemi dan sebaliknya bila terjadi penurunan kadar insulin akan disertai pula dengan hipoamilinemi. Hiperinsulinemi dan hiperamilinemi dapat menyertai keadaan resistensi insulin/ sindrom metabolik dan DM tipe 2. Terjadinya amiloidosis ( penumpukan endapan amilin) didalam islet diduga berhubungan dengan lama dan beratnya resistensi insulin dan DM tipe 2. Sebaliknya , penumpukan endapan amilin didalam sel-sel beta pankreas akan menurunkan fungsinya dalam mensekresi insulin. Sakuraba dan kawan-kawan dalam penelitiannya mendapatkan bahwa pada penderita DM tipe 2, peningkatan stres oksidatif berhubungan dengan peningkatan pembentukan IAPP didalam sel-sel beta pankreas. Dalam keadaan ini terjadi penurunan ekspresi enzim Super Oxide Dismutase (SOD) yang menyertai pembentukan IAPP dan penurunan massa sel beta. Temuan ini menunjukkan adanya hubungan antara terjadinya stres oksidatif dan pembentukan IAPP serta penurunan massa dan densitas sel-sel beta pankreas. Amilin juga dapat merangsang lipolisis dan merupakan salah satu mediator terjadinya resistensi insulin.
Baru-baru ini ditemukan pula amylin binding site didalam korteks ginjal, dimana amilin dapat mengaktivasi RAAS dengan akibat terjadinya peningkatan kadar rennin dan aldosteron. Janson dan kawan-kawan mendapatkan adanya partikel2 amiloid (intermediate sized toxic amyloid particles = ISTAPs) yang bersifat sitotoksik terhadap sel-sel beta pankreas, dapat mengakibatkan apoptosis dengan cara merusak membran sel beta pankreas.
- Inflamasi
Dalam beberapa tahun terakhir, terbukti bahwa inflamasi tidak hanya menimbulkan komplikasi Sindrom Koroner Akut, tetapi juga merupakan penyebab utama dalam proses terjadinya dan progresivitas aterosklerosis. Berbagai pertanda inflamasi telah ditemukan didalam lesi aterosklerosis, antara lain sitokin dan growth factors yang dilepaskan oleh makrofag dan T cells. Sitokin akan meningkatkan sintesis Platelet Activating Factor (PAF), merangsang lipolisis, ekspresi molekul2 adhesi dan upregulasi sintesis serta ekspresi aktifitas prokoagulan didalam sel-sel endotel. Jadi sitokin memainkan peran penting tidak hanya dalam proses awal terbentuknya lesi aterosklerosis, melainkan juga progresivitasnya. Pelepasan sitokin lebih banyak terjadi pada penderita DM, karena peningkatan dari berbagai proses yang mengaktivasi makrofag ( dan pelepasan sitokin ) , antara lain oksidasi dan glikoksidasi protein dan lipid. Pelepasan sitokin yang dipicu oleh terbentuknya Advanced Glycosylation Endproducts (AGEs) akan disertai dengan over produksi berbagai growth factors seperti :
– PDGF (Platelet Derived Growth Factor)
– IGF I (Insulin Like Growth Factor I)
– GMCSF (Granulocyte/Monocyte Colony Stimulating Factor)
– TGF-a (Transforming Growth Factor-a)
Semua faktor ini mempunyai pengaruh besar terhadap fungsi sel-sel pembuluh darah. Disamping itu terjadi pula peningkatan pembentukan kompleks imun yang mengandung modified lipoprotein. Tingginya kadar kompleks imun yang mengandung modified LDL, akan meningkatkan risiko komplikasi makrovaskular pada penderita DM baik DM tipe 1 maupun DM tipe 2. Kompleks imun ini tidak hanya merangsang pelepasan sejumlah besar sitokin tetapi juga merangsang ekspresi dan pelepasan matrix metalloproteinase-1 (MMP-1) tanpa merangsang sintesis inhibitornya. Aktivasi makrofag oleh kompleks imun tersebut akan merangsang pelepasan Tumor Necrosis Factor a (TNF a) , yang menyebabkan up regulasi sintesis C-reactive protein. Baru-baru ini telah ditemukan C-reactive protein dengan kadar yang cukup tinggi pada penderita dengan resistensi insulin. Peningkatan kadar kompleks imun pada penderita DM tidak hanya menyebabkan timbulnya aterosklerosis dan progresivitasnya, melainkan juga berperan dalam proses rupturnya plak aterosklerotik dan komplikasi Jantung Koroner selanjutnya. Kandungan makrofag didalam lesi aterosklerosis pada penderita DM mengalami peningkatan, sebagai akibat dari peningkatan rekrutmen makrofag kedalam dinding pembuluh darah karena pengaruh tingginya kadar sitokin. Peningkatan oxidized LDL pada penderita DM akan meningkatkan aktivasi sel T yang akan meningkatkan pelepasan interferon g . Pelepasan interferon g akan menyebabkan gangguan homeostasis sel-sel pembuluh darah. Aktivasi sel T juga akan menghambat proliferasi sel-sel otot polos pembuluh darah dan biosintesis kolagen, yang akan menimbulkan vulnerable plaque, sehingga menimbulkan komplikasi Sindrom Koroner Akut.
Sampai sekarang masih terdapat kontroversi tentang mengapa pada pemeriksaan patologi anatomi, plak pada DM tipe 1 bersifat lebih fibrous dan calcified, sedangkan pada DM tipe 2 lebih seluler dan lebih banyak mengandung lipid. Dalam suatu seri pemeriksaan arteri koroner pada penderita DM tipe 2 setelah sudden death, didapatkan area nekrosis , kalsifikasi dan ruptur plak yang luas. Sedangkan pada penderita DM tipe 1 ditemukan peningkatan kandungan jaringan ikat dengan sedikit foam cells didalam plak yang memungkinkan lesi aterosklerosisnya relatif lebih stabil.
- Trombosis/Fibrinolisis
Diabetes Melitus akan disertai dengan keadaan protrombotik yaitu perubahan-perubahan proses trombosis dan fibrinolisis. Kelainan ini disebabkan karena adanya resistensi insulin terutama yang terjadi pada penderita DM tipe 2. Walaupun demikian dapat pula ditemukan pada penderita DM tipe 1. Peningkatan fibrinogen serta aktifitas faktor VII dan PAI-1 baik didalam plasma maupun didalam plak aterosklerotik akan menyebabkan penurunan urokinase dan meningkatkan aggregasi platelet. Penyebab peningkatan fibrinogen diduga karena meningkatnya aktifitas faktor VII yang berhubungan dengan terjadinya hiperlipidemi post prandial. Over ekspresi PAI-1 diduga terjadi akibat pengaruh langsung dari insulin dan pro insulin. Penelitian terbaru menunjukkan bahwa penurunan kadar PAI-1 setelah pengobatan DM tipe 2 dengan thiazolidinediones menyokong hipotesis adanya peranan resistensi insulin dalam proses terjadinya over ekspresi PAI-1. Peningkatan PAI-1 baik didalam plasma maupun didalam plak aterosklerotik tidak hanya menghambat migrasi sel otot polos pembuluh darah, melainkan juga disertai penurunan ekspresi urokinase didalam dinding pembuluh darah dan plak aterosklerotik. Terjadinya proteolisis pada daerah fibrous cap dari plak yang menunjukkan peningkatan aktivasi sel T dan makrofag akan memicu terjadinya ruptur plak dengan akibat terjadinya Sindrom Koroner Akut.. Mekanisme yang mendasari terjadinya keadaan hiperkoagulasi pada penderita DM dan resistensi insulin, masih dalam penelitian lebih lanjut.
- Dislipidemia
Dislipidemia yang akan menimbulkan stres oksidatif umum terjadi pada keadaan resistensi insulin/sindrom metabolik dan DM tipe 2. Keadaan ini terjadi akibat gangguan metabolisme lipoprotein yang sering disebut sebagai “lipid triad”, meliputi :
- Peningkatan kadar VLDL atau trigliserida
- Penurunan kadar HDL cholesterol
- Terbentuknya small dense LDL yang lebih bersifat aterogenik.
Peningkatan kadar VLDL, trigliserida dan small dense LDL cholesterol serta penurunan kadar HDL cholesterol yang bersifat anti-aterogenik, anti oksidan dan anti inflamasi akan mengurangi cadangan anti oksidan alamiah.
Lipoprotein mempunyai fungsi mengangkut lipid keseluruh tubuh, dimana LDL terutama berperan dalam transpor apolipoprotein (Apo) B 100; VLDL berperan dalam transpor trigliserida yang mengandung Apo E, sedangkan HDL berperan dalam mengangkut kembali cholesterol yang mengandung anti inflamasi dan anti oksidan alamiah yaitu Apo A. Molekul2 protein dari lipoprotein ini akan mengalami modifikasi karena proses oksidasi, glikosilasi dan glikoksidasi dengan hasil akhir akan terjadi peningkatan stres oksidatif dan terbentuknya Spesies Oksigen Radikal. Disamping itu modified lipoprotein akan mengalami retensi didalam tunica intima yang memicu terjadinya aterogenesis.
- Hipertensi
Hipertensi merupakan salah satu faktor dalam resistensi insulin/ sindrom metabolik dan sering menyertai DM tipe 2. Sedangkan pada penderita DM tipe 1, hipertensi dapat terjadi bila sudah ditemukan tanda-tanda gangguan fungsi ginjal yang ditandai dengan mikroalbuminuri. Adanya hipertensi akan memperberat disfungsi endotel dan meningkatkan risiko Penyakit Jantung Koroner. Hipertensi disertai dengan peningkatan stres oksidatif dan aktifitas Spesies Oksigen Radikal, yang selanjutnya akan memediasi terjadinya kerusakan pembuluh darah akibat aktivasi Ang II dan penurunan aktifitas enzim SOD. Sebaliknya glukotoksisitas akan menyebabkan peningkatan aktifitas RAAS sehingga akan meningkatkan risiko terjadinya hipertensi. Penelitian terbaru mendapatkan adanya peningkatan kadar amilin (hiperamilinemi) pada individu yang mempunyai riwayat keluarga hipertensi dan dengan resistensi insulin.
- Hiperhomosisteinemi
Pada penderita DM baik DM tipe 1 maupun DM tipe 2 ditemukan polimorfisme gen dari enzim methylene tetrahydrofolate reductase yang dapat menyebabkan hiperhomosisteinemi. Polimorfisme gen ini terutama terjadi pada penderita yang kekurangan asam folat didalam dietnya. Hiperhomosisteinemi dapat diperbaiki dengan suplementasi asam folat. Homosistein terutama mengalami peningkatan bila terjadi gangguan fungsi ginjal. Peningkatan kadar homosistein biasanya menyertai penurunan laju filtrasi glomerulus. Hiperhomosisteinemi dapat menyebabkan inaktivasi nitrat oksida melalui hambatannya terhadap ekspresi glutathione peroxidase (GPx).
Manifestasi klinis :
Pada individu non DM, Penyakit Jantung Koroner dapat memberikan manifestasi klinis berupa :
- Angina pektoris :
- Rasa nyeri dada dan sesak nafas yang disebabkan karena gangguan suplai oksigen yang tidak mencukupi kebutuhan otot jantung. Keadaan ini terutama terjadi pada saat latihan fisik atau adanya stres.
- Angina Pektroris tidak stabil :
- Dikatakan Angina Pektoris tidak stabil bila nyeri timbul untuk pertama kali, atau bila Angina Pektoris sudah ada sebelumnya namun menjadi lebih berat. Dan biasanya dicetuskan oleh faktor yang lebih ringan dibanding sebelumnya. Keadaan ini harus diwaspadai karena kelainan bisa berlanjut menjadi berat, bahkan menjadi infark miokard.
- Infark miokard :
- Kerusakan otot jantung akibat blokade arteri koroner yang terjadi secara total dan mendadak. Biasanya terjadi akibat ruptur plak aterosklerosis didalam arteri koroner.
- Secara klinis infark miokard ditandai dengan nyeri dada seperti pada Angina Pektoris, namun lebih berat dan berlangsung lebih lama sampai beberapa jam. Tidak seperti pada AP yang dicetuskan oleh latihan dan dapat hilang dengan pemakaian obat nitrat dibawah lidah, pada infark miokard biasanya terjadi tanpa dicetuskan oleh latihan dan tidak hilang dengan pemakaian nitrat.
- Kadang-kadang gejala bisa berupa sesak nafas, atau sinkope (kehilangan kesadaran).
- Biasanya disertai komplikasi seperti ; gangguan irama jantung, renjatan jantung (shock cardiogenic), gagal jantung kiri, bahkan kematian mendadak (sudden death).
- Sindrom koroner akut :
- Spektrum klinis yang terjadi mulai dari Angina Pektoris tidak stabil sampai terjadi Infark Miokard Akut.
Pada penderita DM, terjadinya iskemi atau infark miokard kadang-kadang tidak disertai dengan nyeri dada yang khas (Angina Pektoris). Keadaan ini dikenal dengan Silent Myocardial Ischaemia atau Silent Myocardial Infarction (SMI). Terjadinya SMI pada penderita DM diduga disebabkan karena :
- Gangguan sensitivitas sentral terhadap rasa nyeri
- Penurunan kadar b endorphin
- Neuropati perifer yang menyebabkan denervasi sensorik.
Diagnosis :
Diagnosis Penyakit Jantung Koroner pada penderita Diabetes Melitus ditegakkan berdasarkan :
- Anamnesis dan pemeriksaan fisik
Pada penderita DM tipe 1, yang umumnya datang tanpa disertai faktor2 risiko tradisional, lamanya menderita DM dapat dijadikan sebagai prediktor penting terhadap timbulnya Penyakit Jantung Koroner. Karena DM tipe 1 sering terjadi pada usia muda, Penyakit Jantung Koroner dapat terjadi pada usia antara 30 sampai 40 tahun. Sebaliknya pada penderita DM tipe 2, sering disertai dengan berbagai faktor risiko, dan PJK biasanya terjadi pada usia 50 tahun keatas. Seringkali, DM baru terdiagnosis pada saat pasien datang dengan keluhan angina, infark miokard atau payah jantung. Sedangkan pada penderita DM dengan SMI, gejala yang timbul biasanya tidak khas seperti mudah capek, dyspnoe d’effort atau dispepsia.
- Pemeriksaan laboratorium meliputi :
- Darah rutin
- Kadar gula darah puasa
- Profil lipid :
- Kolesterol total
- HDL kolesterol
- LDL kolesterol
- Trigliserida
- Enzim2 jantung
- C-reactive protein (CRP)
- Mikroalbuminuri atau proteinuri
- Elektrokardiografi
- Uji latih (Treadmill test)
- Pemeriksaan foto dada
- Ekhokardiografi
- Pemeriksaan baku emas adalah angiografi koroner (kateterisasi)
The American Diabetes Association (ADA) merekomendasikan pemeriksaan2 sebagai berikut :
- Elektrokardiografi (EKG) sebagai pemeriksaan awal terhadap setiap pasien DM
- Uji latih (Treadmill test) dilakukan terhadap penderita DM dengan :
- Gejala-gejala angina pektoris
- Dyspnoe d’effort
- Gejala2 gastrointestinal
- EKG istirahat menunjukkan tanda2 iskemi atau infark miokard
- Disertai penyakit arteri perifer atau oklusi arteri karotis
- Disertai adanya 2 atau lebih faktor2 risiko kardiovaskular sebagai berikut :
- Kolesterol total ≥ 240 mg/dl
- LDL kolesterol ≥ 160 mg/dl
- HDL kolesterol ≤ 35 mg/dl
- Tekanan darah > 140/90 mmHg
- Merokok
- Riwayat keluarga menderita PJK
- Mikroalbuminuri atau proteinuri
Penatalaksanaan :
Berdasarkan rekomendasi ADA, penatalaksanaan terhadap semua pasien DM terutama ditujukan terhadap penurunan risiko kardiovaskular secara komprehensif , yaitu meliputi :
- Pengobatan hiperglikemi dengan diet, obat-obat hipoglikemik oral atau insulin
- Pengobatan terhadap dislipidemi
- Pemberian aspirin
- Pengobatan terhadap hipertensi untuk mencapai tekanan darah < 130/80 mmHg dengan ACE inhibitor, Angiotensin Receptor Blockers (ARB) atau b blocker dan diuretik
- Menasihati pasien untuk berhenti merokok.
Individualisasi penatalaksanaan DM tipe 2 yang disertai Penyakit kardiovaskular
Suatu meta analisis dari 102 studi prospektif menunjukkan bahwa kadar glukosa darah puasa yang lebih dari atau sama dengan 126 mg/dl meningkatkan risiko terjadinya penyakit jantung koroner. Disamping itu, gangguan toleransi glukosa dan peningkatan kadar HbA1c > 5,7 % juga dapat disertai dengan peningkatan risiko penyakit kardiovaskular. Peningkatan kadar glukosa darah pada populasi umum atau pada pasien yang mengalami penyakit kardiovaskular aterosklerotik, juga akan meningkatkan risiko mortalitas kardiovaskular. Individualisasi penatalaksanaan glukosa darah dapat memperbaiki prognosis kardiovaskular pada pasien DM tipe 2. Panduan dari AHA, ADA, ESC dan ESC/EASD merekomendasikan target kadar HbA1c < 7%, dan merekomendasikan target yang lebih longgar pada pasien2 usia lanjut dan pasien dewasa yang dalam kondisi lemah.
Pilihan obat anti diabetes
Obat-obat penurun kadar glukosa darah yang baru, yaitu sodium-glucose co transporter 2 inhibitor (SGLT2i) dan glucagon-like peptide-1 receptor agonists (GLP-1 RA) menunjukkan penurunan risiko penyakit kardiovaskular aterosklerotik dan payah jantung, tidak tergantung pada kadar HbA1c baseline. Kedua regimen ini direkomendasikan untuk digunakan dalam pendekatan baru terapi DM tipe 2.
Metformin
The UK Prospective Diabetes Study (UKPDS) mendapatkan bahwa terapi dengan metformin menurunkan mortalitas semua penyebab sebesar 36% dan kejadian serangan jantung sebesar 39% pada pasien-pasien DM tipe 2 baru dengan berat badan lebih. Selanjutnya, terjadi penurunan risiko komplikasi mikrovaskular, infark miokard dan kematian setelah 10 tahun pemberian metformin. Pemberian metformin dapat merupakan pencegahan primer terhadap risiko penyakit kardiovaskular pada pasien-pasien DM tipe 2 tanpa penyakit kardiovaskular. Namun tidak cukup bukti tentang pemberian metformin untuk pencegahan sekunder pada pasien-pasien DM tipe 2 yang sudah mengalami penyakit kardiovaskular.
SGLT-2 inhibitor
Ada 3 studi meta-analisis yang menunjukkan bahwa SGLT-2 inhibitor memberikan manfaat sebagai berikut :
- menurunkan MACE (major adverse CV events) sebesar 11% pada pasien-pasien DM tipe 2 dan penyakit kardiovaskular aterosklerotik
- menurunkan risiko kematian kardiovaskular atau hospitalisasi akibat payah jantung sebesar 23 % dan risiko perburukan penyakit ginjal sebesar 45% diantara pasien-pasien DM tipe 2.
SGLT-2 inhibitor juga menurunkan risiko aritmia jantung dan progresi atrial fibrilasi/ atrial flutter. Saat ini SGLT-2 inhibitor yang sudah mendapatkan persetujuan FDA antara lain : empaglifozin, canaglifozin, dapaglifozin, ertuglifozin, tofoglifozin, luseoglifozin, dan ipraglifozin.
GLP-1 receptor agonists
Ada 5 CVOTs (Cardiovascular Outcome Trials) yaitu LEADER3, SUSTAIN-6, REWIND, HARMONY, dan AMPLITUDE-O yang secara konsisten menunjukkan keamanan dan efektivitas dari GLP-1 receptor agonists pada pasien-pasien DM tipe 2, dan menunjukkan bukti memberikan efek pencegahan sekunder pada pasien-pasien DM tipe 2 dengan penyakit kardiovaskular dan penyakit ginjal. GLP-1 receptor agonists menunjukkan efek menguntungkan terhadap luaran penyakit kardiovaskular, payah jantung dan ginjal serta penurunan berat badan, tekanan darah, kadar HbA1c dan LDL cholesterol.
Obat-obat anti diabetes lain
Dipeptidylpeptidase-4 (DPP4) inhibitor dilaporkan bersifat netral terhadap luaran kardiovaskular. Namun saxagliptin dikatakan dapat meningkatkan hospitalisasi payah jantung, oleh karena itu perlu kehati-hatian dalam penggunaannya. Sulfonilurea, yang merupakan obat penurun glukosa darah yang relatif murah dan telah lama dikenal, dapat diberikan pada pasien-pasien DM tipe 2 dengan penyakit kardiovaskular. The UKPDS telah membuktikan terjadi penurunan risiko komplikasi mikrovaskular pada penggunaan sulfonylurea. Disamping itu the TOSCA.IT trial membuktikan bahwa penggunaan sulfonylurea memberikan keamanan kardiovaskular. Insulin merupakan pilihan terapi yang cukup luas digunakan pada pasien-pasien DM tipe 2. Suatu studi meta-analisis menunjukkan bahwa terapi insulin tidak meningkatkan risiko kematian kardiovaskular dan infark miokard. Suatu randomized controlled trial menunjukkan bahwa insulin glargine mempunyai efek yang netral terhadap luaran kardiovaskular. pioglitazone dapat menurunkan luaran makrovaskular sekunder pada pasien-pasien DM tipe 2 tanpa penyakit kardiovaskular yang terkontrol dengan metformin monoterapi. Walaupun the PROactive trial tidak menunjukkan efek pioglitazone terhadap luaran primer, namun obat ini berhasil menurunkan luaran sekunder yaitu 3 komponen klasik dari “Major Adverse Cardiovascular Events (MACE)”. Pioglitazone dapat digunakan sebagai terapi tambahan pada pasien DM tipe 2 yang sudah mendapatkan terapi metformin.
Obat-obat hipertensi
Adanya hipertensi pada pasien DM tipe 2 secara bermakna dapat meningkatkan risiko penyakit kardiovaskular. Suatu studi yang mengevaluasi penurunan tekanan darah sistolik mencapai <120 mmHg dan diastolik mencapai <70 mmHg, dapat menurunkan mortalitas, komplikasi makro maupun mikrovaskular. Jadi penurunan tekanan darah dapat menurunkan risiko penyakit kardiovaskular dan komplikasi mikrovaskular baik pada pasien dengan maupun tanpa DM tipe 2. Panduan terapi dari ADA dan ESC merekomendasikan terapi dengan golongan obat-obat yang dapat menurunkan risiko penyakit kardiovaskular pada pasien-pasien DM tipe 2 dan hipertensi, yaitu kombinasi terapi ACE inhibitor atau ARB dengan dihydropyridine calcium channel blocker atau diuretik thiazide sebagai terapi lini pertama. ACE inhibitor dan ARB dapat menurunkan risiko onset baru DM pada pasien-pasien dengan HFrEF (heart failure reduced ejection fraction). Penggunaan sacubitril-valsartan pada pasien-pasien dengan HFrEF (heart failure reduced ejection fraction) dalam the PARADIGM-HF trial diikuti dengan penurunan penggunaan insulin dibandingkan dengan kelompok enalapril. Perbaikan kendali glikemik pada kelompok sacubitril-valsartan dibandingkan dengan enalapril ini adalah karena efek tambahan dari hambatan terhadap neprilysin. Neprilysin diketahui dapat merangsang lipolysis, meningkatkan oksidasi lipid dan meningkatkan kapasitas oksidatif jaringan otot. Hambatan terhadap neprilysin oleh sacubitril dapat memperbaiki parameter glikemik. Disamping itu, karena GLP-1 dapat mengalami degradasi tidak hanya oleh DPP-4, melainkan juga oleh pengaruh neprilysin, maka potensiasi sinyal reseptor GLP-1 dapat terjadi akibat kerja sacubitril-valsartan.
Tatalaksana dilipidemia
Konsep “lower is better” terhadap kadar LDL, telah diterima sebagai upaya untuk menurunkan risiko penyakit kardiovaskular pada pasien-pasien DM tipe 2 dengan dislipidemia. Panduan dari ADA merekomendasikan intervensi modifikasi gaya hidup, harus dimulai pada pasien-pasien dengan kadar trigliserida yang abnormal (> 150 mg/dl) dan atau kadar HDL-C (< 40 mg/dl pada laki-laki, < 50 mg/dl pada wanita), dan target penurunan kadar LDL-C ≥ 50% atau lebih dari baseline untuk pasien-pasien diabetes dan risiko penyakit kardiovaskular aterosklerosis 10 tahun 20% atau lebih. Panduan ESC/EASD merekomendasikan target penurunan LDL-C < 55 mg/dl untuk pasien-pasien DM tipe 2 dan yang mempunyai risiko penyakit kardiovaskular yang sangat tinggi. Panduan AHA merekomendasikan target penurunan kadar LDL-C ≥ 50% dari baseline pada pasien-pasien DM tipe 2 dan penyakit kardiovaskular klinis. Studi meta-analisis menunjukkan bahwa statin merupakan obat yang paling efektif dalam menurunkan mortalitas kardiovaskular, diikuti oleh PCSK9 inhibitor dan kombinasi statin dengan ezetimibe.
Terapi antiplatelet
DM tipe 2 disertai dengan peningkatan trombogenisitas darah diantara pasien-pasien yang mengalami sindrom koroner akut non-ST elevasi. Ekspresi platelet P2Y12 mengalami peningkatan 4 kali lipat pada pasien-pasien DM tipe 2 dan aktivasi platelet serta hiperkoagulasi pada DM tipe 2 memicu timbulnya kondisi protrombotik yang akan meningkatkan risiko terjadinya bencana kardiovaskular. Studi meta-analisis menunjukkan bahwa penggunaan aspirin untuk pencegahan primer terhadap kejadian kardiovaskular perlu dipertimbangkan kembali, karena manfaat kardiovaskularnya tidak konsisten serta meningkatkan risiko perdarahan. Namun pada studi meta-analisis untuk pencegahan sekunder, aspirin dosis menengah (75 sampai 325 mg) dapat menurunkan kejadian kardiovaskular selama 2 tahun, dan aspirin dosis 75-150 mg perhari memberi proteksi terhadap kejadian oklusi pembuluh darah. Dibandingkan dengan aspirin, P2Y12 inhibitor dapat menurunkan risiko infark miokard dan stroke berulang. Jadi P2Y12 inhibitor dapat digunakan untuk pencegahan sekunder. Yang termasuk golongan P2Y12 inhibitor antara lain prasugrel, ticagrelor dan clopidogrel. Pemakaian clopidogrel jangka panjang dapat menurunkan risiko infark miokard dan kematian kardiovaskular, dimana secara keseluruhan efektivitasnya lebih superior dibandingkan aspirin. Rivaroxaban terbukti menunjukkan penurunan kejadian penyakit kardiovaskular dan risiko perdarahan pada pasien-pasien dengan sindrom koroner kronik. Dibandingkan dengan warfarin, rivaroxaban menurunkan kejadian stroke, infark miokard, dan MACE dengan risiko perdarahan yang lebih rendah diantara pasien-pasien dengan atrial fibrilasi dan diabetes.
Rekomendasi ADA tentang target yang harus dicapai dalam penatalaksanaan Diabetes Melitus dalam upaya menurunkan risiko kardiovaskular :
|
No |
Parameter |
Target yang harus dicapai |
|
1. |
Kontrol glikemik : |
|
|
|
– A1C |
< 7 % |
|
|
Kadar glukosa darah preprandial |
90 – 130 mg/dl (5.0 – 7.2 mmol/l) |
|
|
Kadar glukosa darah postprandial |
< 180 mg/dl (< 10.0 mmol/l) |
|
|
|
|
|
2. |
Tekanan darah |
< 130/80 mmHg |
|
|
|
|
|
3. |
Lipid : |
|
|
|
LDL |
< 100 mg/dl (< 2.6 mmol/l) |
|
|
Trigliserida |
< 150 mg/dl (< 1.7 mmol/l) |
|
|
HDL |
> 40 mg/dl (>1.1 mmol/l) |
Referensi :
- AHA Scientific Statement. Type 2 Diabetes Mellitus and Heart Failure. Circulation 2019;140:e294-e324. DOI : 10.1161/CIR.000000000000691.
- American Diabetes Association. Standards of Medical Care for Patients with Diabetes Mellitus (Position Statement). Diabetes Care 2003;26 (S1): 33-50.
- Aronow WS. Silent MI. Prevalence and prognosis in older patients diagnosed by routine Geriatrics 2003;58:24-40.
- Calles-Escandon J, Mirza SA, Garcia-Rubi E, Mortensen A. Type 2 DM: one disease, multiple cardiovascular risk factors. Coron Artery Dis 1999;10:23-30.
- Canto ED, Ceriello A, Ryden L, et.al. Diabetes ad cardiovascular risk factor : An overview of global trends of macro and microvascular complications. European Journal of Preventive Cardiology 2019;26(2S):25-32. DOI: 10-1177/2047487319878371.
- Giugliano D, Ceriello A, Paolisso G. Oxidative stress and diabetic vascular complications. DM Care 1996;19:257–267.
- Giugliano D, Maiotino MI, Bellastella G,et.al. Glycemic Control, Preexisting Cardio-vascular Disease, and Risk ofMajor Cardiovascular Events in Patients with Type 2 Diabetes Mellitus: Systematic Review With Meta-Analysis of Cardiovascular
Outcome Trials and Intensive Glucose Control Trials. J Am Heart Assoc 2019;8:e012356. DOI: 10.1161/JAHA.119.012356. - Haffner SM, Lehto S, Ronnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with Type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998;339:229-34.
- Hayden MR, Tyagi SC. “A” is for amylin and amyloid in type 2 DM mellitus. JOP. J Pancreas (Online) 2001;2:124-39.
- Hogikyan RV, Galecki AT, Pitt B, Halter JB, Greene DA, Supiano MA. Specific impairment of endothelium-dependent vasodilation in subjects with type 2 DM independent of obesity. J Clin Endocrinol Metab 1998;83:1946-1952.
- Jialal I, Crettaz M, Hachiya HL, Kahn CR, Moses AC, Buzney SM, King GL. Characterization of the receptors for insulin and the insulin-like growth factors on micro-and macrovascular tissues. Endocrinology 1985;117:1222–1229.
- Kenny HC, Abel ED. Heart Failure in Type 2 Diabetes Mellitus, Impact of Glucose-Lowering Agents, Heart Failure Therapies, and Novel Therapeutic Strategies. Circ Res 2019; 124:121-141. DOI:10.1161/CIRCRESAHA.118.311371.
- Krauss RM. Lipids and Lipoproteins in Patients With Type 2 Diabetes Diabetes Care 2004;27:1496–1504.
- Lauer MS. Coronary artery disease in diabetes: Which (if any) test is best? Cleveland Clin J Med 2005;72 (1):6-9.
- Ma CX,Ma CN,Guan CH, et.al. Cardiovascular disease in tyrp2 diabetes mellitus : progress toward personalized management. Cardiovascular Diabetology 2022;21(74): 1-15. https://doi.org/10.1186/s12933-022-01516-6
- Pinkney JH, Downs L, Hopton M, Mackness MI, Bolton CH. Endothelial dysfunction in Type 1 DM mellitus: relationship with LDL oxidation and the effects of vitamin E. Diabet Med 1999;16:993–999.
- Quyyumi AA. Endothelial function in health and disease: new insights into the genesis of cardiovascular disease. Am J Med 1998;105:32S-39S.
- Shahab A, Libriansyah, Saraswati MR (editor). Q&A Lipid : Perkeni Lipid Fighters 2023, cetak pertama, Februari 2023, PB Perkeni, Jakarta.
- Sharma A, Mittal S, Aggrawal R, Chauhan MK. Diabetes and cardiovascular disease: inter-relation of risk factors and treatment. Future Journal of Pharmaceutical Sciences 2020;6(130):2-19.
- Steinberg HO, Chaker H, Leaming R, Johnson A, Brechtel G, Baron AD. Obesity/insulin resistance is associated with endothelial dysfunction. Implications for the syndrome of insulin resistance. J Clin Invest 1996;97:2601-2610.
- Tabibiazar R, Edelman S. Silent Ischemia in People With Diabetes: A Condition That Must Be Heard. Clin Diab 2003;21 (1):5-9.
- Valensi P, Henry P, Boccara F, et.al. Risk stratification and screening for coronary artery disease in asymptomatic patients with diabetes mellitus : Position paper of the French Society of Cardiology and the French-speaking Society of Diabetology. Diabetes & Metabolism 2021;47:101185. https://doi.org/10.1016/j.diabet.2020.08.002
- Zellweger MJ,Pfisterer ME. Silent coronary artery disease in patients with diabetes mellitus. Swiss Med Wkly 2001;131:427–432.
Tatalaksana perioperatif pada kelainan fungsi kelenjar tiroid
Alwi Shahab
Pendahuluan
Gangguan fungsi kelenjar tiroid merupakan kelainan endokrin terbanyak kedua setelah diabetes melitus. Prevalensi abnormalitas kadar thyrotropin (TSH) ditemukan sebanyak 21% pada wanita dan 3 % pada pria. Karena efek hormon tiroid terhadap tubuh sangat banyak, maka pengaruh gangguan fungsi kelenjar tiroid akan memberikan dampak terhadap prosedur operasi dan pemulihan pasca operasi, baik operasi tiroid (tiroidektomi) maupun operasi non tiroid. Walaupun penapisan rutin untuk mendeteksi kelainan tiroid tidak indikatif pada pasien-pasien yang tidak menunjukkan kecurigaan adanya kelainan tiroid, namun pengenalan, diagnosis dan tatalaksana kelainan tiroid yang terjadi sebelumnya pada pasien-pasien yang akan menjalani operasi merupakan pertimbangan perioperatif yang penting.
Penapisan preoperatif
Pemeriksaan fungsi tiroid preoperatif secara rutin tidak direkomendasikan pada pasien-pasien yang tidak mempunyai riwayat gangguan fungsi kelenjar tiroid. Pada pasien-pasien yang dicurigai adanya kelainan fungsi tiroid seperti adanya gejala-gejala perubahan berat badan, palpitasi, takikardia atau bradikardia, tremor atau perubahan bowel habits, perubahan pada kulit dan rambut atau adanya exophthalmos/ proptosis dan struma, dapat dipertimbangkan untuk dilakukan pemeriksaan faal tiroid (free T4 & TSH). Juga pada pasien-pasien yang sudah diketahui mengalami hipotiroid atau hipertiroid dan sedang menjalani pengobatan, pemeriksaan faal tiroid hendaklah dimasukkan dalam penilaian preoperatif untuk mengevaluasi efektivitas dan optimalisasi pengobatan sebelum dilakukan operasi.
Tabel 1 memperlihatkan beberapa pemeriksaan penunjang yang perlu dilakukan untuk penapisan preoperatif pada pasien dengan kecurigaan kelainan fungsi tiroid ataupun yang telah terdiagnosis kelainan fungsi tiroid sebelumnya untuk mengevaluasi kondisi perioperatif.
Tabel 1. Pemeriksaan penunjang untuk penapisan preoperatif pada pasien dengan kecurigaan kelainan fungsi tiroid
|
Pemeriksaan |
Jenis pemeriksaan |
Kemungkinan hasil terkait |
|
Laboratorium |
Darah rutin, glukosa darah, elektrolit, ureum, kreatinin, faal tiroid. |
Anemia –> hipotiroid Neutrocytopenia –> hipertiroid Hipoglikemi, hiponatremia –> hipotiroid Hiperglikemia –> hipertiroid
|
|
Radiologi |
Foto thorax PA, CT thorax, MRI thorax |
Kardiomegali Kompresi atau deviasi trachea Evaluasi kompresi trachea pada daerah anteroposterior Evaluasi stenotic region dan ekstensi dari retrosternal goiter |
|
Kardiorespirasi |
Elektrokardiografi Ekokardiografi Test Faal Paru |
Sinus takhikardia dan atrial fibrilasi –> hipertiroid Bradikardia, heart block, prolonged QT –> hipotiroid Penurunan kontraktilitas jantung, efusi perikardial, gagal jantung –> hipotiroid Gagal jantung, iskemia –> hipertiroid
|
Sumber : Sharma MP, Cetera B. Thyroid disease and surgery. Anaesthesia and intensive care medicine.2020. https://doi.org/10.1016/j.mpaic.2020.09.001
Komplikasi hipotiroid
Hormon tiroid berperan penting dalam mempertahankan homeostasis tubuh karena efeknya terhadap sistem kardiovaskular, pernafasan, ginjal, saluran cerna, hematologi, dan syaraf pusat. Perhatian terhadap sistem kardiovaskular lebih diutamakan dalam persiapan perioperatif. Pasien-pasien dengan hipotiroid berada dalam risiko tinggi untuk mengalami penyakit jantung koroner, dikarenakan peningkatan kadar kolesterol, pemanjangan waktu paruh faktor-faktor koagulasi dan adanya anemia. Perubahan gelombang ST nonspesifik dan voltase rendah pada EKG sering ditemukan pada hipotiroid. Disamping itu pada EKG juga kadang-kadang ditemukan “torsade de pointes” ventricular tachycardia. Hipotiroid juga disertai dengan penurunan curah jantung sebesar 30 sampai 50%, dengan perlambatan denyut dan kontraktilitas jantung. Defisiensi hormon tiroid juga akan meningkatkan tahanan vaskular perifer yang akan mengakibatkan peningkatan beban jantung, penurunan tekanan nadi melalui peningkatan tekanan darah diastolik dan penurunan tekanan darah sistolik.
Walaupun kadar katekolamin meningkat, pasien-pasien hipotiroid mempunyai predisposisi untuk mengalami hipotensi dibawah pengaruh anestesi, yang diduga karena down regulasi reseptor beta adrenergik. Disamping dampak terhadap sistem kardiovaskular, pasien-pasien hipotiroid akan menghadapi tantangan tambahan berupa gangguan ventilasi dan manifestasi renal. Efusi pleura dan kelemahan otot pernafasan akan menyebabkan peningkatan risiko terjadinya obstructive sleep apnea (OSA), yang merupakan predisposisi untuk terjadinya pneumonia dan atelektasis. Peningkatan antidiuretic hormone (ADH) dapat menyebabkan hiponatremia, karena penurunan aktifitas atrial natriuretic factor (ANF) dan the renin-angiotensin-aldosteron system (RAAS). Meningkatnya permeabilitas kapiler dan perpindahan cairan kedalam ruang ekstra vaskular akan menurunkan volume intravaskular dan perfusi ginjal yang mengakibatkan penurunan klirens obat-obatan yang diberikan. Akibat pengaruh faktor pulmonal dan renal ini, akan terjadi peningkatan kepekaan pasien hipotiroid terhadap obat-obat anestesi, transquilizer dan narkotika. Penurunan motilitas saluran cerna yang sering bermanifestasi konstipasi pada pasien-pasien hipotiroid, akan meningkatkan kecenderungan untuk terjadinya ileus post operatif. Hipotiroid juga disertai dengan berbagai gangguan hematologi. Sering ditemukan adanya anemia normokrom normositer. Namun, karena meningkatnya prevalensi anemia pernisiosa diantara pasien-pasien hipotiroid, defisiensi vitamin B12 otoimun yang terjadi dapat menyebabkan anemia makrositer. Disamping itu, pada wanita premenopause, menorrhagia sekunder akibat hipotiroid dapat menyebabkan anemia mikrositer karena defisiensi besi. Manifestasi hematologik lain pada hipotiroid dapat berupa penurunan aktifitas faktor VIII, pemanjangan partial thromboplastin time dan terjadinya acquired von Willebrand disease. Komplikasi operasi pada pasien-pasien hipotiroid yang jarang namun paling ditakuti adalah koma miksedema, dengan angka kematian yang masih tinggi, yaitu diatas 80%. Koma miksedema ditandai dengan adanya perubahan mental berat, dengan manifestasi berupa koma atau kejang, hipotermi, bradikardi, hiponatremi, payah jantung dan hipopnea. Terjadinya koma miksedema dapat dipicu oleh karena pembedahan, infeksi, paparan dingin dan pemakaian obat-obat sedatif.
Efek sistemik dari hipotiroid yang dapat meningkatkan risiko pembedahan dapat dilihat pada tabel 2.
Tabel 2 : Efek sistemik dari hipotiroid yang dapat meningkatkan risiko pembedahan
|
SISTEM |
EFEK |
|
Metabolik |
– Hipotermia – Gangguan obat – Hipoglikemia |
|
Integumen |
– Mudah mengalami memar |
|
Kardiak |
– Efusi perikard – Gangguan curah jantung – Peningkatan tahanan vaskular sistemik – Penurunan volume darah – Gangguan respons baroreceptor – Bradiaritmia – Abnormalitas EKG (voltase rendah, gelombang T mendatar dan terbalik) |
|
Pulmonal |
– Miksedema larynx – Makroglossia – Penurunan kapasitas pernafasan – Gangguan DLCO (diffusion capacity of carbon monoxide) – Gangguan pernafasan hipoksia dan hiperkapnik – Efusi pleura |
|
Gastrointestinal |
– Penurunan peristaltik usus – Ascites – Perdarahan saluran cerna |
|
Hematologi |
– Anemia normokrom normositer – Penurunan platelet adhesiveness – Penurunan faktor-faktor pembekuan |
|
Renal |
– Abnormalitas klirens cairan bebas – Hiponatremia |
|
Sistem syaraf pusat |
– Kebingungan – Psikosis – Stupor – Koma – Gangguan aliran darah otak |
(Sumber : Pronovost PH, Parris KH. Perioperative management of thyroid disease. 1995;98(2):83-98.)
Tatalaksana preoperatif pada pasien-pasien hipotiroid
Perubahan patofisiologik yang menyertai hipotiroid biasanya bersifat reversibel bila diberikan terapi pengganti hormon tiroid. Oleh karena itu, untuk menghindari risiko dekompensasi akut akibat hipotiroid berat, lebih baik menunda operasi elektif sampai tercapai kondisi eutiroid dengan terapi pengganti hormon tiroid yang adekuat. Terapi pengganti levotiroksin dosis penuh biasanya diberikan sebesar 1,6 ug/kg BB/hari. Namun pada pasien usia lanjut yang diketahui menderita penyakit jantung koroner, dosis awal dimulai 25 ug/hari, yang perlahan dinaikkan setiap 2 sampai 6 minggu sampai mencapai keadaan eutiroid. Setelah kadar TSH mencapai normal, operasi dapat dilakukan. Pada hari menjelang operasi, pasien diperbolehkan tidak minum obat karena harus berpuasa untuk persiapan operasi. Levotiroksin mempunyai waktu paruh yang cukup panjang yaitu sekitar 7 hari, jadi masih dapat mempertahankan kondisi eutiroid pada saat operasi. Bila masih belum bisa diberikan levotiroksin oral selama 5 hari setelah operasi, sebaiknya diberikan levotiroksin intravena dengan dosis antara 60% sampai 80% dari dosis oral. Pada kasus-kasus dimana tindakan operasi tidak elektif, risiko yang terjadi akibat tindakan operasi harus diperhitungkan secara matang. Sayangnya, sampai saat ini belum ada studi acak skala besar yang membandingkan luaran post operatif pada pasien hipotiroid dan eutiroid. Suatu studi prospektif yang membandingkan luaran post operatif pada pasien-pasien hipotiroid subklinis dan eutiroid yang menjalani coronary artery bypass grafting (CABG) tidak terjadi peningkatan major adverse cardiovascular events (MACE), permasalahan luka operasi, mediastinitis, infeksi tungkai, komplikasi pernafasan, gangguan kesadaran, atau reoperasi selama perawatan dirumah sakit. Hanya saja terjadi peningkatan kejadian atrial fibrilasi pada kelompok pasien hipotiroid subklinis. Suatu studi retrospektif menganalisis luaran anestesi dan operasi pada 59 pasien hipotiroid dan 50 pasien eutiroid. Tidak ada perbedaan lamanya operasi dan anestesi, suhu tubuh dan tekanan darah selama operasi, kebutuhan vasopressor, waktu ekstubasi, gangguan keseimbangan cairan dan elektrolit, kejadian aritmia atau infark miokard, sepsis, kebutuhan alat bantu nafas post operatif, komplikasi perdarahan dan lamanya perawatan dirumah sakit. Dalam suatu studi retrospektif yang lain, 40 pasien hipotiroid yang terdiri dari pasien hipotiroid ringan dan sedang, dibandingkan dengan 80 pasien eutiroid. Diantara mereka yang menjalani operasi non kardiak, hipotensi intra operatif terjadi lebih banyak pada kelompok hipotiroid. Pada pasien-pasien yang menjalani operasi kardiak, terjadinya payah jantung lebih banyak pada kelompok hipotiroid. Disamping itu kelompok hipotiroid lebih banyak yang mengalami komplikasi gastro intestinal dan neuropsikiatrik. Walaupun operasi elektif lebih baik ditunda pelaksanaannya sampai mencapai keadaan eutiroid, namun pada pasien-pasien yang membutuhkan operasi segera atau emergensi, operasinya dapat dilanjutkan dengan terlebih dahulu diberikan levotiroksin preoperatif, disertai peningkatan kewaspadaan terhadap timbulnya komplikasi post operatif. Kadar hormon tiroid harus dinormalkan secepat mungkin dengan pemberian levotiroksin intravena loading dose 200 sampai 500 ug, dilanjutkan 50 sampai 100 ug perhari. Penambahan pemberian liothyronine intravena hendaklah dipertimbangkan bila terdapat kecurigaan timbulnya koma miksedema. Bila terdapat kecurigaan timbulnya insufisiensi adrenal, hendaklah diberikan glukokortikoid dosis tinggi sebelum atau bersamaan dengan pemberian levotiroksin. Namun pada pasien-pasien hipotiroid dengan angina pectoris, kemungkinan akan terjadi perburukan iskemi miokard bila diberikan hormon tiroid, karena akan meningkatkan kebutuhan oksigen miokard. Disamping itu, pada kenyataannya, dari hasil studi retrospektif maupun prospektif, pasien-pasien jantung yang menjalani operasi jantung maupun kateterisasi, tidak ditemukan peningkatan kejadian MACE pada pasien-pasien hipotiroid yang tidak diobati. Jadi prosedur revaskularisasi dapat dilanjutkan sebelum diberikan terapi pengganti hormon tiroid.
Komplikasi hipertiroid
Sebagaimana hipotiroid, manifestasi klinis dari peningkatan kadar hormon tiroid pada tirotoksikosis dapat mengenai berbagai sistem organ tubuh. Gambaran klinis yang mencolok adalah manifestasi kardiovaskular yaitu berupa efek ionotropik dan kronotropik positif dari hormon tiroid terhadap jantung, vasodilatasi dan penurunan tahanan vaskular sistemik, serta peningkatan retensi cairan dan natrium yang dimediasi oleh sistem renin-angiotensin-aldosteron. Semua efek ini akan menyebabkan peningkatan curah jantung sebesar 50% sampai 300%. Atrial fibrillasi dapat terjadi pada 10% sampai 15% dari pasien dengan hipertiroid nyata maupun hipertiroid subklinis, dan persentase atrial fibrilasi meningkat dengan bertambahnya usia. Efek sistemik dari hipertiroid yang dapat meningkatkan risiko operasi dapat dilihat pada tabel 3 dibawah ini :
Tabel 3 : Efek sistemik hipertiroid yang dapat meningkatkan risiko operasi
|
SISTEM |
EFEK |
|
Metabolik |
– Meningkatkan klirens obat-obatan – Keseimbangan nitrogen negatif – Hipoalbuminemia – Gangguan toleransi glukosa – Hiperkalsemia – Upregulasi reseptor beta |
|
Kardiak |
– Peningkatan curah jantung – Peningkatan volume darah total – Peningkatan tahanan vaskular sistemik – Peningkatan efek kronotropik/ inotropik – Hipertrofi ventrikel kiri – Kardiomiopati – Angina pektoris – Atrial fibrilasi – Payah jantung kongestif – Thromboemboli |
|
Pulmonal |
– Disfungsi respirasi – Miopati |
|
Hematologi |
– Anemia – Netropenia – Thrombositopenia – Peningkatan faktor VIII – Penurunan faktor dependen vitamin K (faktor II,VII,IX,X) |
|
Gastrointestinal |
– Gangguan absorpsi obat-obat. |
(Sumber : Pronovost PH, Parris KH. Perioperative management of thyroid disease. 1995;98(2):83-98.)
Optimalisasi status kardiovaskular pre operatif pada pasien-pasien hipertiroid
Sampai saat ini tidak ada studi yang mengevaluasi luaran perioperatif pada pasien-pasien hipertiroid dibandingkan pasien-pasien eutiroid. Hipertiroid dapat memicu terjadinya badai tiroid sehingga akan menimbulkan kolaps kardiovaskular, oleh karena itu operasi elektif sebaiknya ditunda pada pasien-pasien dengan hipertiroid yang nyata (overt hyperthyroidism). Namun pada pasien-pasien dengan hipertiroid ringan atau hipertiroid subklinis, pemberian obat penyekat beta pre operatif cukup memberikan perlindungan terhadap bencana kardiovaskular. Hal ini didukung oleh suatu studi prospektif yang menunjukkan bahwa pada pasien-pasien hipertiroid yang menjalani tiroidektomi, yang sebelumnya hanya diberikan metoprolol pre operatif selama 5 minggu, tidak ditemukan komplikasi serius baik intra maupun post operatif. Untuk pasien-pasien dengan hipertiroid nyata yang memerlukan tindakan operasi cito atau darurat, status fungsi jantung harus dimonitor dengan ketat. Pada pasien-pasien dengan gangguan fungsi kardiopulmonal atau hemodinamik yang tidak stabil, perlu dipasang alat monitor central venous pressure perioperatif. Optimalisasi status fungsi jantung harus dilakukan pre operatif dengan pemberian obat penyekat beta. Pada kebanyakan kasus, atenolol lebih disenangi. Atenolol merupakan golongan beta 1-selektif, yang dapat ditoleransi dengan lebih baik pada pasien-pasien yang mengalami gangguan saluran nafas reaktif. Karena metabolisme obat ini mengalami peningkatan pada keadaan tirotoksikosis, maka dosis harian atenolol perlu dibagi dalam 2 dosis. Dosis atenolol dapat dimulai 25 mg perhari, namun pada kasus-kasus yang berat memerlukan dosis yang lebih tinggi, yaitu antara 50 mg sampai 200 mg. Walaupun propranolol merupakan obat penyekat beta 1 dan beta 2 yang non selektif dengan waktu paru yang pendek sehingga memerlukan dosis harian multipel, namun obat ini memberikan manfaat tambahan yaitu dapat menghambat enzim monodeiodinase tipe 1 sehingga dapat menghambat konversi T4 menjadi T3 yang lebih aktif secara biologis. Propranolol dapat diberikan juga secara intravena untuk mengendalikan denyut jantung dan tekanan darah, bahkan dapat menurunkan demam intra operatif. Penghambat kanal kalsium dapat digunakan pada pasien-pasien yang tidak tolerans terhadap obat penyekat beta. Obat ini hendaklah dititrasi sampai mencapai target denyut jantung dibawah 80 kali permenit.
Pada kasus-kasus hipertiroid yang terjadi karena peningkatan sintesis hormon tiroid seperti penyakit Graves dan struma nodosa toksik, obat anti tiroid harus segera diberikan untuk menurunkan kadar hormon tiroid. Golongan thionamides, yaitu PTU, metimazol dan karbimazol, bekerja menghambat produksi hormon tiroid namun tidak mempengaruhi pelepasan hormon tiroid yang sudah terbentuk. Jadi efeknya baru terlihat dalam beberapa hari. Metimazol mempunyai waktu paru yang lebih panjang sehingga dapat diberikan dengan dosis satu atau dua kali sehari, sedangkan PTU mempunyai waktu paruh yang lebih pendek, sehingga harus diberikan setiap 6 sampai 8 jam. Metimazol dapat dimulai dengan dosis 20 mg sampai 30 mg perhari, sedangkan PTU dapat diberikan dengan dosis 100 sampai 150 mg setiap 6 sampai 8 jam. PTU mempunyai manfaat tambahan, dapat menghambat konversi T4 menjadi T3. Disamping itu PTU lebih aman diberikan pada trimester pertama kehamilan karena efek teratogeniknya lebih rendah dibandingkan metimazol. Namun kedua obat ini mempunyai efek toksik yang sama. Keduanya dapat menyebabkan agranulositosis. Efek samping ini pada metimazol berhubungan dengan dosis, dan jarang terjadi pada dosis dibawah 40 mg perhari. Sebaliknya pada PTU, efek samping ini bersifat idiosinkrasi dan tidak berhubungan dengan dosis. Sebaiknya hindari pemakaian kedua golongan obat ini pada pasien-pasien yang pernah mengalami efek samping salah satu dari keduanya, karena dapat terjadi sensitivitas silang.
Pemberian bersamaan obat penyekat beta dan thionamide dapat mempercepat persiapan pasien untuk dilakukan operasi dalam beberapa minggu. Obat-obat ini hendaklah dilanjutkan selama periode post operatif untuk mencegah terjadinya badai tiroid. Pada pasien-pasien yang menjalani operasi tiroidektomi, thionamide sebaiknya dihentikan post operatif dan segera diberikan levotiroksin apabila kadar hormon tiroidnya mengalami penurunan.
Bila diperlukan stabilisasi cepat dari keadaan tirotoksikosis, dapat diberikan iodida inorganik sebagai tambahan dari thionamide, yang bekerja memblok organifikasi iodium, dan menurunkan sintesis hormon tiroid. Iodium dapat diberikan secara oral, rektal atau intravena. Sediaan yang umum diberikan adalah saturated solution of kalium iodide (SSKI) dengan dosis 1 tetes 3 kali sehari, atau larutan Lugol dengan dosis 3 sampai 5 tetes 3 kali sehari.
Glukokortikoid dapat menurunkan konversi tiroksin menjadi triiodotironin dalam beberapa jam, sehingga dapat ditambahkan pre operatif dan dosis hendaklah diturunkan bertahap selama 3 hari post operatif. Regimen yang dianjurkan adalah hidrokortison 100 mg oral atau intravena setiap 8 jam, deksametazon 2 mg oral atau intravena setiap 6 jam atau betametazon 0,5 mg oral, intramuskular atau intravena setiap 6 jam. Kolestiramin merupakan modalitas tambahan yang dapat digunakan untuk menurunkan secara cepat kadar hormon tiroid pada pasien-pasien tirotoksikosis. Dalam suatu studi, dengan dosis 4 gram 4 kali sehari, kolestiramin dapat menurunkan kadar hormon tiroid dalam sirkulasi melalui cara mengikat hormon tiroid didalam usus halus dan menurunkan reabsorpsinya. Karena sirkulasi ekstrahepatik dari hormon tiroid mengalami peningkatan pada pasien tirotoksikosis, pengikatan resin ini sangat efektif.
Asosiasi tiroid Amerika telah menerbitkan Panduan Diagnosis dan Tatalaksana Hipertiroid dan penyebab-penyebab lain dari Tirotoksikosis, secara spesifik merekomendasikan tatalaksana tiroidektomi pada pasien Graves hendaklah dipertahankan dalam keadaan eutiroid sebelum tiroidektomi, dengan obat-obat anti tiroid, dengan atau tanpa obat penyekat beta. Potassium iodida hendaklah diberikan segera pada periode preoperatif. Bila tidak mungkin mempertahankan pasien dalam keadaan eutiroid sebelum tiroidektomi atau bila pasien alergi terhadap obat anti tiroid, pasien hendaklah diterapi dengan obat penyekat beta, kalium yodida, glukokortikoid, dan kolestiramin, pada periode pre operatif.
Pada kasus-kasus tirotoksikosis akibat intoksikasi hormon tiroid eksogen (thyrotoxicosis factitia), tidak ada target terapi spesifik selain pemberian obat penyekat beta atau calcium channel blocker untuk menstabilkan status kardiovaskular. Pada kasus dimana etiologi tirotoksikosis adalah tiroiditis dimana peningkatan kadar hormon tiroid disebabkan karena meningkatnya pelepasan hormon tiroid bukan karena peningkatan produksinya, maka dalam hal ini tidak ada peran dari obat anti tiroid. Anti inflamasi non steroid merupakan terapi yang disarankan untuk kasus ini. Untuk semua pasien dengan tirotoksikosis apapun penyebabnya, kortikosteroid, asam iopanoat, dan kolestiramin dapat dipertimbangkan, karena fungsinya tidak tergantung dengan produksi hormon tiroid. Steroid dan asam iopanoat dapat menurunkan konversi T4 menjadi T3 tanpa memandang sumber T4 itu sendiri, sedangkan kolestiramin dapat menurunkan absorpsi hormon tiroid didalam usus halus tanpa memandang apakah diproduksi secara endogen atau berasal dari eksogen. Panduan dari Asosiasi Tiroid Amerika juga menganjurkan pemberian suplementasi kalsium oral dan vitamin D preoperatif pada pasien-pasien yang akan menjalani tiroidektomi, untuk mengurangi risiko hipokalsemia postoperatif akibat cedera paratiroid atau peningkatan bone turn over.
Simpulan
Permasalahan perioperatif pada pasien-pasien dengan kelainan fungsi kelenjar tiroid memerlukan perhatian khusus menyangkut pemeriksaan preoperatif yang seksama, tatalaksana dan optimalisasi status fisiologik dan perubahan-perubahan anatomik yang menyertai kelainan fungsi kelenjar tiroid. Pemahaman yang komprehensif tentang berbagai aspek penyakit tiroid dan tindakan operatif baik operasi kelenjar tiroid maupun operasi non tiroid sangat diperlukan. Kewaspadaan yang tinggi terhadap adanya kelainan fungsi tiroid dan tatalaksana yang baik sebelum dilakukan tindakan operatif serta penundaan operasi elektif akan memperbaiki luaran perioperatif.
Referensi :
- Hilmes CP, Ganesh R, Wight EC, Simha V, Liebow M. Perioperative Evaluation and Management of Endocrine Disorders. Mayo Clin Proc. December 2020;95(12):2760 – 2774. https://doi.org/10.1016/j.mayocp.2020.05.004.
- Hsieh LB,Yen TWF, Dream S, Patel D, Evans DB, Wang TS. Perioperative Manage-ment and Outcomes of Hyperthyroid Patients Unable to Tolerate Antithyroid Drugs. World J Surg https://doi.org/10.1007/s00268-020-05654-4.
- Malhotra B, Bhadada SK. Perioperative management for Non-Thyroidal Surgery in Thyroid Dysfunction. Indian J Endocr Metab 2022;26:428-434.
- Palace MR. Perioperative Management of Thyroid Dysfunction. Health Service Insights 2017:1-5. DOI: 10.1177/1178632916689677.
- Pronovost PH, Parris KH. Perioperative management of thyroid disease. 1995;98(2):83-98.
- Sharma MP, Cetera B. Thyroid disease and surgery. Anaesthesia and intensive care m2020. https://doi.org/10.1016/j.mpaic.2020.09.001
- Stathatos N, Wartofsky L. Perioperative management of patients with hypothyroidism. Endocrinol Metab Clin N Am 2003;32:503-518.
- Terefe M, Bizuneh YB, Nigatu YA, Melesse DY. Perioperative management of the thyrotoxic patients : A systematic review. Annals of Medicine and Surgery 2022;81(104487):1-8. https://doi.org/10.1016/j.amsu.2022.104487.
Adiposopati sebagai kontributor terjadinya sindrom metabolik
Alwi Shahab
Pendahuluan
Istilah ” fat ” diartikan sebagai sel dan jaringan yang menyimpan lemak (lipid), yaitu sel-sel adiposit dan jaringan adiposa. Lipid berasal dari kata “lipos” yaitu terdiri dari lemak hewani dan lemak nabati. Adipositas diartikan lemak tubuh, berasal dari kata “adipo” yang berarti lemak. Sel-sel adiposit dan jaringan adiposa menyimpan sejumlah besar lemak tubuh, yang terdiri dari trigliserida dan kolesterol bebas. Sel-sel adiposit dan jaringan adiposa merupakan jaringan endokrin dan jaringan imun yang aktif. Hipertrofi sel-sel adiposit dan akumulasi jaringan adiposa yang berlebihan akan menimbulkan gangguan fungsi adiposit dan jaringan adiposa, yang akan mengakibatkan peningkatan kadar lipid didalam sirkulasi yang merupakan faktor risiko utama untuk terjadinya penyakit jantung koroner. Gangguan fungsi adiposit dan jaringan adiposa ini disebut sebagai adiposopati. Tinjauan pustaka ini secara ringkas akan membahas tentang patofisiologi terjadinya gangguan fungsi adiposit dan jaringan adiposa serta dampaknya terhadap peningkatan risiko terjadinya sindrom metabolik.
Patofisiologi :
Adiposopati dipicu oleh asupan nutrisi yang tidak sehat dan gaya hidup sedenter pada seorang individu yang secara genetik suseptibel. Gangguan adipogenesis jaringan adiposa perifer subkutan pada saat keseimbangan kalori yang positif, akan menyebabkan hipertrofi sel-sel lemak, peningkatan asam lemak bebas didalam sirkulasi dan akan terjadi endapan lemak didalam organ-organ non adiposa seperti hati, otot dan pankreas. Keadaan ini akan menyebabkan lipotoksisitas. Respons imun dan endokrin dari kondisi ini dapat langsung menyebabkan gangguan fungsi sistem kardiovaskular atau organ-organ tubuh yang lain. Adiposopati secara tidak langsung dapat pula menyebabkan atau memicu timbulnya faktor-faktor risiko aterosklerosis seperti DM tipe 2, hipertensi atau dislipidemia.
Gambar 1. Menunjukkan hubungan antara jaringan adiposa patogen dan penyakit kardiovasluar yang dikenal dengan adiposopati.
Di Amerika Serikat, lebih dari 65% populasi orang dewasa termasuk kelompok berat badan lebih dan obes yang disebabkan karena timbunan lemak tubuh yang berlebihan. Akibat buruk terhadap kesehatan karena kelebihan lemak tubuh ini mempunyai korelasi dengan gangguan fungsi jaringan lemak dan berhubungan pula dengan meningkatnya angka kematian akibat penyakit kardiovaskular. Komorbiditas utama yang menyertai keadaan ini adalah dislipidemia. Hasil survei nasional di Amerika Serikat menunjukkan bahwa dislipidemia merupakan komorbiditas yang paling sering terjadi akibat peningkatan indeks massa tubuh. Timbunan lemak tubuh yang berlebihan, terutama pola distribusi abdominal, merupakan prediktor utama resistensi insulin dan sebagai salah satu komponen dari sindrom metabolik. Namun komplikasi metabolik dari adipositas tidak semuanya terjadi pada populasi obes, karena dapat pula terjadi pada subjek dengan indeks massa tubuh yang rendah. Diperkirakan sekitar 32% orang dewasa obes pada populasi the National Health and Nutrition Examination Survey (NHANES), tidak mengalami abnormalitas metabolik, sementara resistensi insulin dan komplikasinya juga terjadi pada kelompok populasi yang tidak obes. Hal ini terutama ditemukan pada kelompok-kelompok ras minoritas tertentu di Amerika Serikat. Peralihan fokus pemahaman dari distribusi massa lemak kepada disfungsi jaringan adiposa atau yang dikenal dengan adiposopati, mendorong minat para ahli untuk mengidentifikasi penanda-penanda baru dari abnormalitas metabolisme lipid dan terjadinya penyakit-penyakit kronik seperti DM tipe 2 dan Penyakit Kardiovaskular. Hipertrofi adiposit yang berlebihan akan menyebabkan gangguan fungsi organella-organella didalam adiposit terutama mitokondria dan retikulum endoplasmik, disregulasi hormon, gangguan penyimpanan asam lemak, peningkatan asam lemak bebas didalam sirkulasi, lipotoksisitas pada organ-organ non adiposa seperti hati, otot dan pankreas. Disamping itu, keseimbangan kalori yang positif disertai proses adipogenesis yang inadekuat pada jaringan adiposa subkutan dapat menyebabkan peningkatan asam lemak bebas pada organ-organ nonadiposa dan peningkatan simpanan energi dan akumulasi lemak didalam depot lemak viseral, perikardial dan perivaskular. Akibat gangguan fungsi hormonal, adiposopati akan diikuti dengan peningkatan produksi spesies oksigen reaktif, stres oksidatif, respons proinflamasi (peningkatan TNF-a, interleukin-6 dan C-reactive protein) dan penurunan respons anti-inflamasi (penurunan adiponektin). Tergantung dari interaksi dengan jaringan tubuh yang lain (seperti otot, hati, pankreas dan lain-lain), konsekuensi dari adiposopati dapat secara langsung menimbulkan aterosklerosis melalui efek patogenik perikardial dan perivaskular atau secara tidak langsung melalui progresivitas penyakit-penyakit metabolik seperti DM tipe 2, hipertensi atau dislipidemia yang semuanya merupakan faktor risiko utama untuk terjadinya penyakit kardiovaskular. Pemahaman baru tentang peranan jaringan adiposa dalam patofisiologi terjadinya gangguan metabolisme lipid dan glukosa memberikan dorongan bagi para klinisi untuk mencari solusi praktis dalam menatalaksana kelainan-kelainan ini. Upaya untuk mengidentifikasi determinan metabolik dari kelainan metabolisme lipid dan glukosa akibat disfungsi jaringan adiposa saat ini sudah banyak dilakukan. Melalui studi tentang perbedaan suseptibilitas etnik terhadap resistensi insulin dan sindrom metabolik pada etnik India Asia, suatu populasi yang mempunyai risiko tinggi untuk mengalami penyakit kardiovaskular dan DM tipe 2, menunjukkan bahwa resistensi insulin berat dapat terjadi pada etnis India Asia usia muda yang tidak obes, yang tidak menunjukkan pola distribusi lemak viseral atau meningkatnya ukuran lingkar pinggang. Berbagai studi menunjukkan adanya abnormalitas dalam pengelolaan asam lemak (lipid handling) oleh jaringan adiposa pada etnis India Asia muda, tidak obes, normoglikemik, dibandingkan etnis Eropa dengan komposisi tubuh dan distribusi lemak yang sama. Investigasi lebih lanjut menunjukkan adanya peran suatu glikoprotein ectonucleotide pyrophosphatase/ phosphodiesterase-1 (ENPP1) dalam patogenesis disfungsi jaringan adiposa dan resistensi insulin pada etnik India Asia dan kelompok etnik minoritas lain di Amerika Serikat. Ekspresi ENPP1 didalam sel adiposit mengalami disregulasi selama proses adipogenesis yang menimbulkan perubahan-perubahan signifikan dalam proses maturasi adiposit dan penyimpanan trigliserida. Over ekspresi dari ENPP1 ini akan menginduksi terjadinya gangguan ambilan glukosa (resistensi insulin seluler) dan penurunan akumulasi lipid (maturasi adiposit). Mekanisme terjadinya gangguan maturasi adiposit yang menyebabkan adiposopati dan komplikasi metabolik sistemik yang diakibatkannya saat ini merupakan topik riset pada banyak laboratorium diseluruh dunia. Dan sedang dikembangkan pula upaya untuk mendapatkan cara yang lebih baik dalam mengidentifikasi dan mengelola pasien-pasien dengan sindrom metabolik.
Daftar Pustaka :
- Bays HE. Adiposopathy: Is ‘‘sick fat’’ a cardiovascular disease? J Am Coll Cardiol. 2011;57:2461–2473.
- Bays HE, Toth PP, et.al. Obesity, adiposity, and dyslipidemia: A consensus statement from the National Lipid Association. Journal of Clinical Lipidology (2013) 7, 304–383.
- Flegal KM, Carroll MD, Kit BK, Ogden CL. Prevalence of obesity and trends in the distribution of body mass index among US adults, 1999-2010. JAMA. 2012;307:491–497.
- National Heart, Lung, and Blood Institue. Classification of Overweight and Obesity by BMI, Waist Circumference, and Associated Disease Risks. http://www.nhlbi.nih.gov/health/public/heart/obesity/ lose_wt/bmi_dis.htm. Accessed March, 2013.
- Sharma AM, Kushner RF. A proposed clinical staging system for obesity. Int J Obes (Lond). 2009;33:289–295.